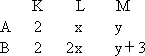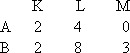题目内容
|
今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍.A和B分别是 | |
| [ ] | |
A. |
硅原子和钠原子 |
B. |
硼原子和氦原子 |
C. |
氯原子和碳原子 |
D. |
碳原子和铝原子 |
答案:D
解析:
解析:
|
剖析:本题考查了原子核外电子的排布.设原子A的L、M两层电子数分别为x、y,依题意,A、B两原子的电子层结构为 原子B的M层至少有3个电子,因而其L层的电子数必然是8个,求得x=4.对原子A来说,L层有4个电子时只能是最外层,即y=0,y+3=3.因此,这两个原子核外电子排布为: 规律总结:“最外层电子数与各电子层电子数间的关系”是一种重要题型.通过本题,要做到举一反三,学会变式训练.1-18号元素原子结构的特殊性如下: a.原子核中无中子的原子: b.最外层有1个电子的元素:H、Li、Na c.最外层有2个电子的元素:He、Be、Mg d.最外层电子数等于次外层电子数的元素:Be、Ar e.最外层电子数是次外层电子数2倍的元素:C;最外层电子数是次外层电子数3倍的元素:O;最外层电子数是次外层电子数4倍的元素:Ne f.电子层数与最外层电子数相等的元素:H、Be、Al g.电子总数为最外层电子数2倍的元素:Be h.次外层电子数是最外层电子数2倍的元素:Li、Si i.内层电子数是最外层电子数2倍的元素:Li、P |

练习册系列答案
相关题目