题目内容
已知2SO2(g)+ O2(g) 2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
(1)写出该反应的热化学方程式。
(2)该反应中SO2的转化率是多少?
(3)其他条件相同,若起始时改为充入2 mol SO3,,计算达平衡后SO3的质量分数为多少?
(6分,每空2分)
(1)2SO2(g)+ O2(g) 2SO3(g) △H=-196 kJ/mol(计量系数和焓变值对应也行)
2SO3(g) △H=-196 kJ/mol(计量系数和焓变值对应也行)
(2) 60%
(3)50%
解析

练习册系列答案
相关题目
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2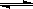 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 |
| B.已知C(石墨,s) ===C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的溶液与足量稀盐酸完全反应,放出的热量为28.7 kJ |
| D.已知2C(s) +2O2 (g) ===2CO2(g) △H1 |
 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: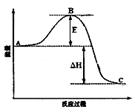
 2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是
2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是