��Ŀ����
����Ŀ����ѧ��ȤС����ʵ�������Ʊ�ijЩ���壬��̽��������ʵ����ʣ���Ҫ����������ͼ��ʾ������װ�ÿ��ظ�ѡȡ����ش��������⣺
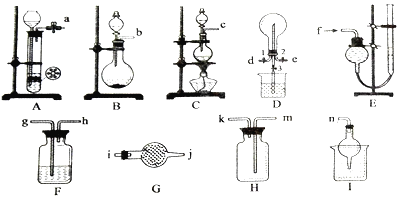
��1���Ʊ����ռ������İ�����
����ѡװ����ȷ������˳��Ϊ_________________(��ӿڱ��)��
���������鰱���IJ�������___________________________________________��
��2���������Ʊ�������ʵ�顣
���Ʊ�װ���з�����Ӧ�����ӷ���ʽ��_______________________��
��������������ͨ�����ȷ������۵���ͨӲ�ʲ������У�������ȡ���Ȼ���(������ˮ),���ڲ������Ҳ���Ҫֱ������һ��_____________װ�á������Ƶõ����Ȼ������Ƴ���Һ���������������____________________��
��������Eװ���ռ����������������,�����Ϊ___________��
��3����״���£���D�п��Է�����Ӧ3Cl2+2NH3=N2+6HCl����������ƿ���ռ�������,Ȼ��ر�ֹˮ��1��3,��ֹˮ��2��ͨ��NH3��������Ӧǡ����ȫ���в��ر�ֹˮ��2������ʱ����ֹˮ��3,D����ƿ�е�����Ϊ____________���Լ�����ƿ��������Һ�����ʵ���Ũ��Ϊ___________��
���𰸡� b(c)��i��j��k��m(��i��j)��n ��ʪ��ĺ�ɫʯ����ֽ(��pH��ֽ)������Ӵ�,����ֽ����˵���ǰ������������� MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O ���� ��FeCl3�����ܽ������������У�Ȼ�������ˮϡ����������� ��������Һ����ƽ,�������ռ�������,�ٴε�������Һ����ƽ������,���ζ�����ֵ��Ϊ���ռ���������� ����Ȫ����,��Һ���Լռ��ƿ�ݻ���2/3
Mn2++Cl2��+2H2O ���� ��FeCl3�����ܽ������������У�Ȼ�������ˮϡ����������� ��������Һ����ƽ,�������ռ�������,�ٴε�������Һ����ƽ������,���ζ�����ֵ��Ϊ���ռ���������� ����Ȫ����,��Һ���Լռ��ƿ�ݻ���2/3 ![]() mol��L-1��0.134mol��L-1��0.13mol��L-1
mol��L-1��0.134mol��L-1��0.13mol��L-1
����������1����ʵ�����Ʊ����������Ȼ�粒�������ʯ�Ҽ��ȷ�Ӧ����Ũ��ˮ����ʯ�ҷ�Ӧ�����ɵİ����к���ˮ��������Ҫ�ü�ʯ�������������ռ�Ϊ�����ſ�������β��������ע���ֹ������������ȷ�𰸣�b(c)��i��j��k��m(��i��j)��n��
��������ˮ��Һ�Լ�������ʪ��ĺ�ɫʯ����ֽ(��pH��ֽ)������Ӵ�,����ֽ����˵���ǰ�������պ��Ũ����IJ������ӽ����壬ð���̣���ȷ��ͬ�ϣ�
��2���������Ʊ�������ʵ�顣
��ʵ�����Ʊ��������ö���������Ũ������ȷ�Ӧ�Ʊ�����ȷ�𰸣�MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
�����Ȼ���������ˮ���������Ҳ���Ҫֱ������һ��װ�м�ʯ�ҵĸ���װ�ã�������ˮ���������ն�������������Ȼ�����ˮ������ˮ�⣬Ϊ��ֹ����ˮ�⣬��FeCl3�����ܽ������������У�Ȼ�������ˮϡ���������������ȷ�𰸣����� ����FeCl3�����ܽ������������У�Ȼ�������ˮϡ�������������
��������ͨ��ԭ����ʹ����Һ���ռ�������Ȼ���������Һ����ƽ���������ռ���������ȴ�����£��ٴε�������Һ����ƽ�����������ζ�����ֵ��Ϊ���ռ������������ ��ȷ������������Һ����ƽ���������ռ����������ٴε�������Һ����ƽ�����������ζ�����ֵ��Ϊ���ռ������������
��3����ӦΪ3Cl2+2NH3=N2+6HCl���Ȼ��⼫������ˮ����ƿ�������ѹǿѸ�ټ��٣���ѹ������ѹ������ʱ����ֹˮ��3��D����ƿ������Ȫ���ɣ���ƿ����Һ���������������Լռ��ƿ�ݻ���2/3����ƿ��������ҺΪ��ˮ������ƿ���ΪVL,���ݷ�Ӧ��ϵ����ϵ�����������ʵ���ΪV/22.4mol,�������ʵ���ΪV/11.2mol, ������Һ�����Ϊռ������ƿ�����2V/3L��������Һ��Ũ��Ϊ��V��11.2��/2V/3= ![]() mol��L-1����ȷ��������Ȫ��������Һ���Լռ��ƿ�ݻ���2/3 ��
mol��L-1����ȷ��������Ȫ��������Һ���Լռ��ƿ�ݻ���2/3 �� ![]() mol��L-1��0.134mol��L-1��0.13mol��L-1��
mol��L-1��0.134mol��L-1��0.13mol��L-1��

����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���ѧ��Ӧ������Ҫ���塣
��1����֪һ�������£���ӦN2+3H2![]() 2NH3Ϊ���ȷ�Ӧ;��
2NH3Ϊ���ȷ�Ӧ;��
����ͼ����ȷ��ʾ�÷�Ӧ�������仯����________��

�ڸ����±����ݣ���������1molNH3ʱ�÷�Ӧ�ų�������Ϊ______kJ��
��ѧ�� | H-H | N��N | N-H |
�Ͽ�1mol�������յ����� | 436kJ | 946kJ | 391kJ |
��һ���¶��£���3molH2��1molN2ͨ���ݻ�Ϊ2 L���ܱ������з�����Ӧ����5min�ﵽƽ�⣬���c(NH3)=0.4mol/L����0��5min��N2��ƽ����ѧ��Ӧ����v(N2)=______����Ӧ��ʼ��ƽ��ʱ��������ʵ���֮��Ϊ__________�����ﵽƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0 ������p0��p����ʾ�ﵽƽ��ʱH2��ת����Ϊ__________��
�� �ڢ۷�Ӧ�����£��ܹ��жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����______________��
A�������ڻ�������ܶȲ���
B����������ѹǿ����
C����λʱ��������n mol N2 ��ͬʱ����2n mol NH3
D�� v (N2)��2v(NH3)
��2��ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���A��B��C��D���ֽ������±���װ�ý���ʵ�飺

��װ�ü���SO![]() ��________ ���ƶ����A����B������
��________ ���ƶ����A����B������
�����ֽ��������ǿ������˳����_____________��
����װ�ñ��еĵ缫Ϊ������ȵ�������ͭ������ع���һ��ʱ���ȡ��ϴ����������������缫������Ϊ6g��������ͨ�����ӵ����ʵ���Ϊ______mol��




