题目内容
【题目】在密闭容器中通入物质的量浓度均为0.1的CH4与CO2 , 在一定条件下发生反应CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.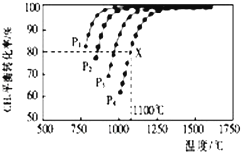
(1)据图可知,p1、p2、p3、p4由大到小的顺序是;
(2)在压强为p4、1100°C的条件下,该反应5min时达到平衡X点,反应的平衡常数为 .
【答案】
(1)P4>P3>P2>P1
(2)1.64
【解析】由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1 , 所以答案是:P4>P3>P2>P1;(2)由图可知,压强为P4、1100℃的条件下,达到平衡X点时甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,则:
CH4(g)+CO2(g)=2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k= ![]() =1.64,
=1.64,
所以答案是:1.64.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案【题目】在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2 , 发生如下反应:( )
CO(g)+2H2(g)CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
甲醇物 时间 | 10min | 20min | 30min | 40min | 50min | 60min |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A.该反应的焓变△H>0,升高温度K增大
B.300℃时,0~20 min H2的平均反应速率 ν(H2)=0.003mol/(Lmin)
C.采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D.500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2 , 依据现有数据可计算出反应达平衡后甲醇的浓度
【题目】下列各组反应(表示物质均为反应物)中,反应刚开始时,放出氢气速率最大的是( )
编号 | 金属(块状) | 酸的浓度及体积 | 反应温度(℃) |
A | 0.2mol Mg | 10 mL2.5 mol·L-1硫酸 | 60 |
B | 0.2mol Mg | 40 mL3 mol·L-1盐酸 | 60 |
C | 0.2mol Fe | 50 mL5 mol·L-1盐酸 | 60 |
D | 0.2mol Mg | 20 mL2.5 mol·L-1硫酸 | 50 |
A. AB. BC. CD. D