题目内容
在①硫酸 ②芒硝 ③三氧化硫 ④硫酸亚铁四种化合物中,硫元素的质量分数由高到低的顺序是
- A.①>②>③>④
- B.③>①>④>②
- C.①>③>④>②
- D.②>③>④>①
B
本题所列选项中化合物化学式中均含一个S,不必具体计算质量分数,只需计算各式量,式量大者,硫元素质量分数就小,反之则大
本题所列选项中化合物化学式中均含一个S,不必具体计算质量分数,只需计算各式量,式量大者,硫元素质量分数就小,反之则大

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
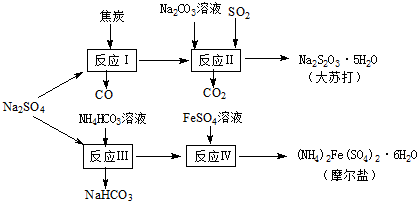 以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下: