题目内容
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
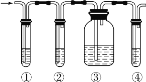
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_______________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
【答案】碱煮水洗 加快反应速率 水浴加热 C 将Fe2+全部氧化为Fe3+,不引入杂质 防止Fe3+水解 NH4Fe(SO4)2·12H2O
【解析】
(1)利用油脂能在碱性条件下水解分析。
(2)根据影响速率的因素分析。根据水浴加热能控制一定的温度范围分析。根据产生的气体成分和防止倒吸进行分析。
(3)根据过氧化氢的反应产物分析。铁离子能发生水解,要抑制其水解。
(4)根据失去的水的比重分析计算晶体中水分子个数。
(1)油污的主要成分为油脂,在碱性条件下能水解,所以可以用碱煮水洗的方法除去;
(2)温度升高可以加快反应速率;温度保持80~95 ℃适合用水浴加热的方法;铁屑中的硫化物和硫酸反应生成硫化氢气体,有毒,应选用氢氧化钠除去,为了防止倒吸,故选C;
(3) 过氧化氢能将Fe2+全部氧化为Fe3+,且不引入杂质;铁离子能水解,所以要控制溶液的pH小于0.5。
(4)设硫酸铁铵的化学式为NH4Fe(SO4)2·xH2O,其相对分子质量为266+18x,失去1.5个水分子的式量为1.5×18=27,失重5.6%,则27/(266+18x)=5.6%,解x=12,所以硫酸铁铵化学式为 NH4Fe(SO4)2·12H2O。