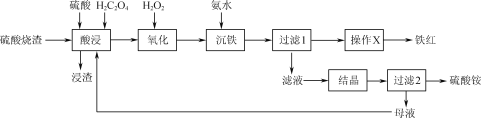
��Ŀ����
����Ŀ��NaClO�㷺������ɱ����ˮ��������Ư���ȡ�
��֪��NaClO��Һ�����ֲַ���������ҺpH�Ĺ�ϵ��ͼ1��ʾ��
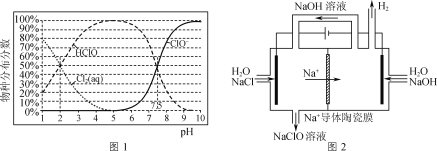
��1����NaClO��Һ��ͨ��CO2��������Ӧ�����ӷ���ʽΪ___(H2CO3��lgKa1��lgKa2����Ϊ-6.38��-10.21)����ӦClO-+H2O![]() HClO+OH-��lgK=____��
HClO+OH-��lgK=____��
��2����Na+�����մ�Ĥ��ⷨ��������������Һ��װ����ͼ2��ʾ��
����������Cl2�ĵ缫��ӦʽΪ____��
�������������䣬����ȥ��Na+�����մ�Ĥ����NaClO�IJ�����ή�ͣ�����Ҫԭ����___��
��3��NaClO��Һ��ClO-��H2O������ǿ�����Ե�HClO���ɽ�ˮ���а�������ΪN2(NH3��NH![]() ���ױ�����)������ʱ��ȡ������ˮ200mL����ת�١�NaClOͶ������ͬ�Ҿ���Ӧ30minʱ����Ӧ��ʼpH��ʣ�ఱ��Ũ�ȼ�����ȥ���ʵ�Ӱ����ͼ3��ʾ��
���ױ�����)������ʱ��ȡ������ˮ200mL����ת�١�NaClOͶ������ͬ�Ҿ���Ӧ30minʱ����Ӧ��ʼpH��ʣ�ఱ��Ũ�ȼ�����ȥ���ʵ�Ӱ����ͼ3��ʾ��
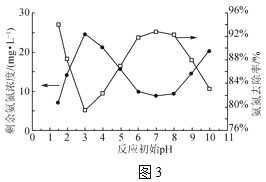
��NaClO����NH3�Ļ�ѧ����ʽΪ___��
��pH��3��7ʱ����pH����ȥ�������ߵ�ԭ����___��
��pH��7��9ʱ����pH����ȥ���ʽ��͵�ԭ����__��
���𰸡�CO2+ClO-+H2O=HCO![]() +HClO -6.5 2Cl--2e-=Cl2�� ClO-��ɢ������������ԭ 2NH3+3NaClO=N2+3H2O+3NaCl ����ҺpH����NH
+HClO -6.5 2Cl--2e-=Cl2�� ClO-��ɢ������������ԭ 2NH3+3NaClO=N2+3H2O+3NaCl ����ҺpH����NH![]() ��ת��Ϊ���ױ�������NH3������ͼ1֪NaClO��Һ����Ҫ�ɷ�Ϊ����������ǿ��HClO NaClO��Һ��ClO-�������������Լ���
��ת��Ϊ���ױ�������NH3������ͼ1֪NaClO��Һ����Ҫ�ɷ�Ϊ����������ǿ��HClO NaClO��Һ��ClO-�������������Լ���
��������
��1������ǿ��HClO��HCO3-������ǿ����ȡ����֪�����߷�Ӧ����̼�����ƺʹ��������ˮ��ƽ�ⳣ���������㣻
��2����������������ʧ���Ӳ���Cl2��
��ClO-��ɢ������������ԭ������NaClO�IJ�����ή�ͣ�
��3����NaClO����NH3���ɵ�����ͬʱ�����Ȼ��ƺ�ˮ��
�ڢ۸���ͼ����Ϣ������߱仯���з�����
��1������ǿ��HClO��HCO3-������ǿ����ȡ����֪�����߷�Ӧ����̼�����ƺʹ����ᣬ���ӷ���ʽΪClO-+CO2+H2O�THClO+HCO3-��
����ͼ����Ϣ��֪��pH=7.5��Ka=c(H+)=10-7.5����ӦClO-+H2O![]() HClO+OH-��K=
HClO+OH-��K= =
= =
=![]() =
=![]() =10-6.5��lgK= lg10-6.5=-6.5��
=10-6.5��lgK= lg10-6.5=-6.5��
��2����������������ʧ���Ӳ���Cl2�������ĵ缫��ӦʽΪ2Cl--2e-=Cl2����
�������������䣬����ȥ��Na+�����մ�Ĥ���� ClO-��ɢ������������ԭ������NaClO�IJ�����ή�ͣ�
��3����NaClO����NH3���ɵ�����ͬʱ�����Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ2NH3+3NaClO=N2+3H2O+3NaCl��
������ҺpH����NH![]() ��ת��Ϊ���ױ�������NH3������ͼ1֪NaClO��Һ����Ҫ�ɷ�Ϊ����������ǿ��HClO����pH��3��7ʱ����pH����ȥ�������ߣ�
��ת��Ϊ���ױ�������NH3������ͼ1֪NaClO��Һ����Ҫ�ɷ�Ϊ����������ǿ��HClO����pH��3��7ʱ����pH����ȥ�������ߣ�
��NaClO��Һ��ClO-�������������Լ�������pH��7��9ʱ����pH����ȥ���ʽ��͡�