题目内容
7.常温下,下列溶液的离子浓度关系正确的是( )| A. | pH=3的醋酸溶液稀释100倍后,溶液的pH=5 | |
| B. | pH=2的盐酸与等体积0.01mol•L-1醋酸钠混合溶液后,溶液中c(Cl-)=c(CH3COO-) | |
| C. | 0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)>c(I-) | |
| D. | 氨水中通入过量CO2后,溶液中c(H+)+c(NH4+)=c(OH-)+c(HCO3-) |
分析 A.醋酸是弱电解质,加水稀释过程中促进醋酸电离,稀释100倍后c(H+)大于原来的$\frac{1}{100}$;
B.pH=2的盐酸与等体积0.01mol•L-1醋酸钠混合溶液后,溶液中溶质为等物质的量浓度的CH3COOH、NaCl,但醋酸是弱电解质,部分电离,NaCl是强电解质,完全电离;
C.Ksp(AgCl)>Ksp(AgI),相同物质的量的AgCl和AgI溶于同一溶液中,溶度积常数大的物质其在溶液中浓度大;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.醋酸是弱电解质,加水稀释过程中促进醋酸电离,稀释100倍后c(H+)大于原来的$\frac{1}{100}$,则稀释后溶液pH在3-5之间,故A错误;
B.pH=2的盐酸与等体积0.01mol•L-1醋酸钠混合溶液后,溶液中溶质为等物质的量浓度的CH3COOH、NaCl,但醋酸是弱电解质,部分电离,NaCl是强电解质,完全电离,所以存在c(Cl-)>c(CH3COO-),故B错误;
C.Ksp(AgCl)>Ksp(AgI),相同物质的量的AgCl和AgI溶于同一溶液中,溶度积常数大的物质其在溶液中浓度大,则存在c(Cl-)>c(I-),故C正确;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,涉及难溶物的溶解平衡、弱电解质的电离、盐类水解等知识点,明确弱电解质电离及盐类水解特点是解本题关键,注意溶液中溶质及其性质,解答离子浓度大小比较时常常用到电荷守恒和物料守恒,电荷守恒和物料守恒与溶液酸碱性及电解质强弱无关,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
17.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 铝片与稀硫酸的反应 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | 甲烷在氧气中的燃烧 | D. | Ba(OH)2•8H2O与NH4Cl的反应 |
18.原子结构为 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )
 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )| A. | 第六周期第IV族 | B. | 第四周期第VI族 | C. | 第六周期第A族 | D. | 第四周期第VIA族 |
15.下列有关离子方程式与所述事实相符且正确的是( )
| A. | 过量的NaHSO4与Ba(OH)2溶液的反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 酸性条件下KIO3和KI溶液反应生成I2:IO3-+5I-+3H2O═3I2+6 OH- | |
| D. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
2.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中:Al3+、NH4+、Cl-、HS- | |
| B. | Na2CO3溶液中:K+、NH4+、SO42-、Cl- | |
| C. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的水溶液中:Ca2+、HCO3-、I-、NO3- |
12.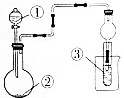 利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
 利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | ③中的现象 |
| A | 浓盐酸 | Na2SO3 | BaCl2溶液 | 出现浑浊 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 出现红色 |
| D | 醋酸 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |
7.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )
| A. | 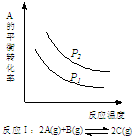 反应:△H>0,P2>P1 | B. | 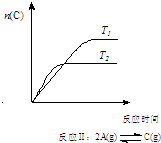 反应:△H<0,T1<T2 | ||
| C. | 反应:△H>0,T2>T1;或△H<0,T2<T1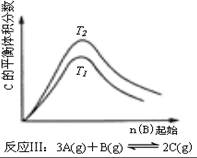 | D. | 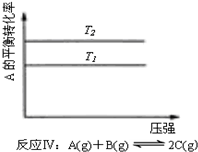 反应:△H<0,T2>T1 |
4.从1897年英国首次使用氯气对给水管网消毒以来,氯气用于自来水消毒已经经历了100多年的历史.目前,我国大多数城市仍然采用氯气消毒法对自来水进行净化、消毒.氯气之所以长期用于自来水消毒,原因是( )
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气用于自来水消毒没有任何有毒物质残留 |
5.某有机物的蒸气完全燃烧时需要3倍于其体积的氧气,产生2倍于其体积的CO2,该有机物可能是( )
| A. | CH3CH3 | B. | CH3CH2OH | C. | CH3CHO | D. | CH3COOH |