题目内容
 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的化合物,已知:①反应C+G
| 高温 |
②I是一种常见的温室气体,它和E可以发生反应:2E+I
| ||
(1)①中反应的化学方程式为
(2)化合物Ⅰ的电子式为
(3)C与过量NaOH溶液反应的离子方程式为
(4)E在I中燃烧观察到的现象是
考点:无机物的推断
专题:推断题
分析:图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的化合物,已知:①反应C+G
B+H能放出大量的热,该反应曾应用于铁轨的焊接,发生的是铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,推断A为O2,;
②I是一种常见的温室气体为CO2,它和E可以发生反应:2E+I
2F+D,推断E为Mg,F为MgO,D为C,计算F中的E元素的质量分数=
×100%=60%.符合;然后结合元素化合物知识及化学用语来解答.
| 高温 |
②I是一种常见的温室气体为CO2,它和E可以发生反应:2E+I
| ||
| 24 |
| 40 |
解答:
解:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,
①反应C+G→B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I
2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
(1)①中反应的化学方程式为2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe;
(2)I为二氧化碳,其电子式为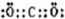 ,为直线型分子,结构式为:O=C=O,故答案为:
,为直线型分子,结构式为:O=C=O,故答案为: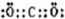 ,O=C=O;
,O=C=O;
(3)C与过量NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,反应后溶液与过量化合物Ⅰ反应是偏铝酸啊和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(5)E在I中燃烧可能观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳;
故答案为:镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳.
①反应C+G→B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I
| ||
(1)①中反应的化学方程式为2Al+Fe2O3
| ||
| ||
(2)I为二氧化碳,其电子式为
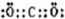 ,为直线型分子,结构式为:O=C=O,故答案为:
,为直线型分子,结构式为:O=C=O,故答案为: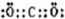 ,O=C=O;
,O=C=O;(3)C与过量NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,反应后溶液与过量化合物Ⅰ反应是偏铝酸啊和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(5)E在I中燃烧可能观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳;
故答案为:镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳.
点评:本题考查无机物的推断,注意利用铝热反应及温室效应气体、Mg与二氧化碳的反应为解答本题的突破口,熟悉Mg、Al及其化合物的性质及氧化还原反应即可解答,题目难度中等.

练习册系列答案
 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列关于溶液和胶体的叙述中不正确的是( )
| A、一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
| B、在胶体中加入少量电解质溶液时,可能使胶体发生聚沉 |
| C、溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D、溶液中溶质粒子直径小于1nm,而胶体粒子直径在1nm~100nm之间 |
相同条件下22克下列气体中跟22克二氧化碳的体积相等的是( )
| A、SO2 |
| B、N2 |
| C、N2O |
| D、CO |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、利用1mol/L FeCl3溶液制得氢氧化铁胶体的胶粒数目一定小于1NA |
| B、10L 18.4mol?L-1硫酸与64g铜加热反应,生成SO2分子的数目一定小于1NA |
| C、通常状况下,22.4L氯气与烧碱溶液完全反应,转移电子数目一定小于1NA |
| D、标准状况下,22.4LHF所含分子数为1NA |
下列有关实验的叙述正确的是( )
| A、浓硝酸可保存在带橡皮塞的棕色细口瓶中 |
| B、用pH试纸测定溶液pH时,pH试纸应事先润湿 |
| C、配制一定物质的量浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定 |
| D、中和滴定时,为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂 |
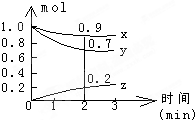 某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答: 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: (1)现有以下物质:
(1)现有以下物质: