题目内容
在N2+3H2
2NH3的反应中,在5s中N2由6mol/L减至2mol/L.则NH3的平均反应速率是( )
| ||
| 高温高压 |
| A、2.4 mol/(L?s) |
| B、1.6mol/(L?s) |
| C、0.8 mol/(L?s) |
| D、0.08 mol/(L?s) |
分析:在5s中N2由6mol/L减至2mol/L,根据反应速率的计算公式:v=
计算出N2的平均反应速率,再根据化学计量数计算出氨气的反应速率.
| △c |
| △t |
解答:解:解:在5s内N2由6mol/L减至2mol/L,所以△c(N2)=6mol/L-2mol/L=4mol/L.
所以5s内N2的平均反应速率为v(N2)=
=0.8mol/(L?s),
各物质的反应速率与化学计量数成正比,氨气的反应速率为:v(NH3)=2v(N2)=0.8mol/(L?s)×2=1.6mol/(L?s),
故选:B.
所以5s内N2的平均反应速率为v(N2)=
| 4mol/L |
| 5s |
各物质的反应速率与化学计量数成正比,氨气的反应速率为:v(NH3)=2v(N2)=0.8mol/(L?s)×2=1.6mol/(L?s),
故选:B.
点评:本题考查反应速率与化学计量数的关系,难度较小,旨在考查学生对基础知识的掌握,化学反应速率计算通常用定义法、化学计量数法求算.

练习册系列答案
相关题目
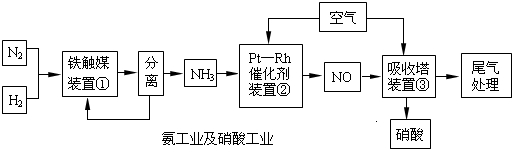
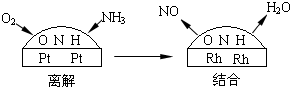
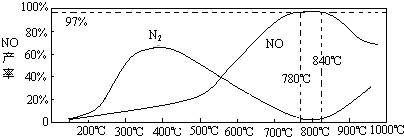

 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.