题目内容
19.向氢氧化钠溶液中通入一定量的二氧化硫气体,再将溶液在减压条件下蒸干,得到一白色固体,此固体的成分不可能是( )| A. | Na2SO3和NaOH | B. | NaHSO3 | C. | Na2SO3和NaHSO3 | D. | NaHSO3和NaOH |
分析 由于SO2和NaOH反应时物质的量之比不同则产物不同,故可根据SO2和NaOH反应时物质的量之比对产物进行讨论.
解答 解:由:①SO2+2NaOH=Na2SO3+H2O ②SO2+NaOH=NaHSO3
可知 $\frac{n(SO{\;}_{2})}{n(NaOH)}$=$\frac{1}{2}$时产物为Na2SO3,
可知 $\frac{n(SO{\;}_{2})}{n(NaOH)}$=1时产物为NaHSO3,
所以 $\frac{n(SO{\;}_{2})}{n(NaOH)}$<$\frac{1}{2}$时,NaOH过量则产物为Na2SO3+NaOH;
$\frac{1}{2}$<$\frac{n(SO{\;}_{2})}{n(NaOH)}$<1时对于①反应来说二氧化硫过量而对于②反应来说二氧化硫量不足,所以产物为Na2SO3+NaHSO3;
$\frac{n(SO{\;}_{2})}{n(NaOH)}$>1时二氧化硫过量,则固体产物为NaHSO3;
所以此固体的成分不可能是NaHSO3和NaOH,故选:D.
点评 本题考查混合物的计算,题目难度中等,关键是根据反应的化学方程式判断可能的反应产物,难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
9.化学能与热能、电能等能相互转化,下列说法正确的是( )

| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化石燃料是可再生能源,燃烧时将化学能转变为热能 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
10.下列物质互为同分异构体的是( )
| A. | 氧气和臭氧 | B. | 正丁烷和异丁烷 | C. | 甲烷和乙烯 | D. | 1H和2H |
4.Na2SO3和浓H2SO4作用产生气体X,碳酸氢铵热分解生成的气体依次通过硅胶、Na2O2、浓H2SO4,最后得到气体Y,将X,Y分别通入氢硫酸中产生的现象是( )
| A. | 通入X溶液浑浊,通入Y无明显现象 | B. | 通入X现象不明显,通入Y溶液浑浊 | ||
| C. | 通入X和Y溶液均无明显现象 | D. | 通入X和Y溶液均浑浊 |
19.用分液漏斗可以分离的一组混合物是( )
| A. | 乙酸乙酯和乙酸 | B. | 溴苯和水 | C. | 溴乙烷和乙醇 | D. | 乙醇和水 |
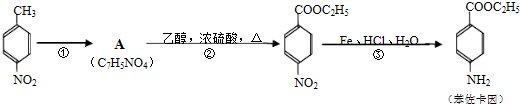
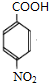 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$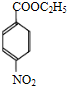 +H2O;
+H2O;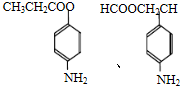 ,则剩余三种同分异构体的结构简式为:
,则剩余三种同分异构体的结构简式为: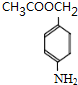 、
、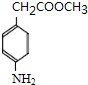 、
、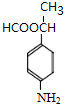 .
.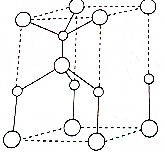 利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构水土,则每个晶胞中含有B原子的个数为2,该功能陶瓷的化学式为BN.
利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构水土,则每个晶胞中含有B原子的个数为2,该功能陶瓷的化学式为BN.
 利用如图所示的装置收集以下7种气体(图中烧瓶位置不得移动)
利用如图所示的装置收集以下7种气体(图中烧瓶位置不得移动)