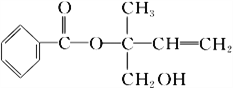
题目内容
【题目】常温下,向10mL1mol/LNH2OH![]() 溶液中加水进行稀释,所得曲线如图所示V表示溶液的体积
溶液中加水进行稀释,所得曲线如图所示V表示溶液的体积![]() ,
,![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()

A.![]() 的电离平衡常数Kb的数量级为
的电离平衡常数Kb的数量级为![]()
B.用![]() 的盐酸滴定10ml1mol/LNH2OH溶液至
的盐酸滴定10ml1mol/LNH2OH溶液至![]() ,消耗盐酸体积小于10mL
,消耗盐酸体积小于10mL
C.当溶液稀释至![]() 时,溶液中由水电离出的
时,溶液中由水电离出的![]()
D.![]() 溶液中离子浓度大小关系:
溶液中离子浓度大小关系:![]()
【答案】C
【解析】
A.依题意![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() ,所以电离平衡常数
,所以电离平衡常数![]() ,故A正确;
,故A正确;
B.用1mol/L的盐酸滴定10mL1mol/LNH2OH溶液,若二者恰好完全反应需要盐酸的体积为10mL,得到的![]() 是强酸弱碱盐,溶液显酸性,若
是强酸弱碱盐,溶液显酸性,若![]() ,消耗盐酸体积应该小于10mL,故B正确;
,消耗盐酸体积应该小于10mL,故B正确;
C.当溶液稀释至![]() 时,溶液
时,溶液![]() ,说明
,说明![]() ,由于
,由于![]() 是一元弱碱,溶液中由水电离出的
是一元弱碱,溶液中由水电离出的![]() ,故C错误;
,故C错误;
D.![]() 是强酸弱碱盐,由于
是强酸弱碱盐,由于![]() 水解溶液显酸性,所以溶液中离子浓度大小关系:
水解溶液显酸性,所以溶液中离子浓度大小关系:![]() ,故D正确;
,故D正确;
故选C。

【题目】氮的氧化物是造成大气污染的主要物质。
(1)用活性炭还原NO的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
浓度mol/L 时间min | NO | N2 | CO2 |
0 | 10 | 0 | 0 |
10 | 5 | 2.5 | 2.5 |
20 | 2 | 4 | 0.25 |
①在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是____。
②在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正___v逆(填“>”“<”或“=”)。
(2)工业上由N2、H2来制备NH3。不同温度下,向三个相同的容器中投入相同的反应物进行反应,测得不同温度时平衡混合物中NH3的物质的量分数随压强增大而变化如图所示。
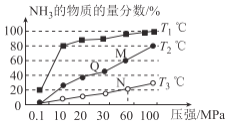
①M点的v正_______Q点的v正(填“>”“<”或“=”)。
②图中三条曲线对应的温度分别为T1、T2、T3,其中温度最高的是____。
③恒温恒容条件下,能说明反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡状态的是____(填选项字母)
2NH3(g)达到平衡状态的是____(填选项字母)
A. 2v(N2)=v(NH3) B.c2(NH3)/[c(N2)c3(H2)]保持不变
C.反应器中的压强不再发生变化 D.3 molH-H键断裂的同时,有2molN-H键断裂
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
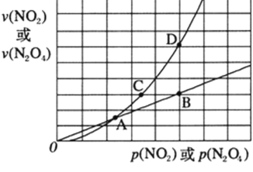
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在上图标出点中,指出能表示反应达到平衡状态的点是______。
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义,该反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
回答下列问题:
(1)0~5min时间内用H2表示的化学反应速率为___mol/(L·min)。
(2)达平衡时CH4的物质的量分数为___,CO2的转化率是___。
(3)反应前后混合气体的压强之比为___。
(4)为了加快反应速率,可采取什么措施___(写两条)。
(5)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
物质 | CH4 | CO2 | CO | H2 |
能量/kJ | 1660 | 1490 | 1072 | 436 |
该催化重整反应中反应物的总能量___生成物的总能量(填“大于”或“小于”)。
(6)下列能表示该反应已经达到化学平衡状态的是___。
A.v逆(CH4)=2v正(CO)
B.CO2的浓度保持恒定
C.混合气体平均相对分子质量不变
D.混合气体密度保持不变