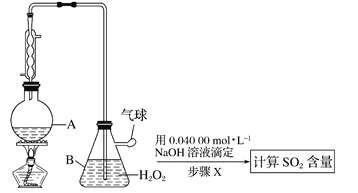
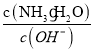题目内容
【题目】工业上采用氨的催化氧化制备硝酸,其反应如下:
4NH3+5O2→4NO+6H2O
4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨﹣空气混合物中氨的体积分数为______
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为______(保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液______________吨?
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
若每生成1mol CO2,吸收溶液质量就增加40g.计算吸收液中NaNO2和NaNO3物质的量之比______________.
【答案】0.14 77.8% 87.4吨 3:1
【解析】
(1)氨气恰好完全氧化为一氧化氮,发生反应4NH3+5O2→4NO+6H2O,氨气和氧气物质的量之比为4:5,即氨气和空气物质的量之比为4:(5÷0.2)=4:25,由此可求出氨气的含量;
(2)由方程式可得反应总方程式:NH3+2O2=HNO3+H2O,为使1mol氨气恰好完全转化化为硝酸,所得硝酸溶液中HNO3与H2O的物质的量之比为1:1,由此可求出HNO3的质量分数;
(3)设用17吨NH3可制取质量分数为0.63的硝酸溶液质量是xmol,可利用N原子守恒建立关系式,NH3——HNO3,从而求出生成硝酸的质量;
(4)反应2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=48g,反应NO+NO2+Na2CO3=2NaNO2+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=32g,实际溶液质量增重40g,上述两个反应都发生,然后设未知数,列方程求解。
(1)氨气恰好完全氧化为一氧化氮,发生反应4NH3+5O2→4NO+6H2O,氨气和氧气物质的量之比为4:5,即氨气和空气物质的量之比为4:(5÷0.2)=4:25,所以氨气所占体积分数即物质的量分数为![]() =0.14,故答案为:0.14;
=0.14,故答案为:0.14;
(2)由方程式可得反应总方程式:NH3+2O2=HNO3+H2O,为使1mol氨气恰好完全转化化为硝酸,所得硝酸溶液中HNO3与H2O的物质的量之比为1:1,故所得硝酸溶液质量分数=77.8%,故答案为:77.8%;
(3)设用17吨NH3可制取质量分数为0.63的硝酸溶液质量是xmol,则:

解得x=87.4t,故答案为:87.4t;
(4)反应2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=48g,反应NO+NO2+Na2CO3=2NaNO2+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=32g,实际溶液质量增重40g,上述两个反应都发生,设由NO2与纯碱反应产生的CO2为amol,由NO和NO2与纯碱反应产生的CO2为bmol,则:a+b=1,48a+32b=40,解得a=b=0.5,所以n(NaNO2):n(NaNO3)=(a+2b):a=1.5:0.5=3:1,故答案为:3:1。

【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________