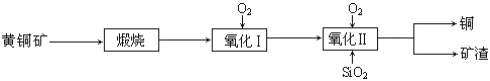
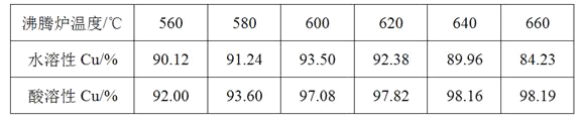
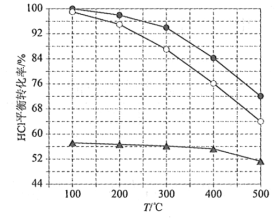
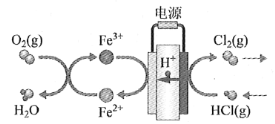
题目内容
【题目】在标准状况下,ag气体A与bg气体B的分子数相同,则与此有关的以下说法中不正确的是
A.气体A与气体B的摩尔质量之比为![]()
B.相同状况下,同体积的气体A与气体B的质量之比为![]()
C.质量相同的气体A与气体B的分子数之比为![]()
D.同温同压下,气体A与气体B的密度之比为![]()
【答案】D
【解析】
A、由n=![]() 可知,分子数相同的气体,物质的量相同,摩尔质量之比等于质量之比,即A与B摩尔质量之比为ag∶bg=a∶b,选项A正确;
可知,分子数相同的气体,物质的量相同,摩尔质量之比等于质量之比,即A与B摩尔质量之比为ag∶bg=a∶b,选项A正确;
B、相同状况下,同体积的A与B的物质的量相同,则质量之比等于摩尔质量之比,即为a∶b,选项B正确;
C、A与B相对分子质量之比为a∶b,由n=![]() 可知,同质量时,分子数之比等于
可知,同质量时,分子数之比等于![]() ∶
∶![]() =b∶a,选项C正确;
=b∶a,选项C正确;
D、同温同压下,Vm相同,由ρ=![]() 可知,密度之比等于摩尔质量之比等于,即为a∶b,选项D错误;
可知,密度之比等于摩尔质量之比等于,即为a∶b,选项D错误;
答案选D。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目