题目内容
(6分)请根据实验目的填写简要的实验方法(包括使用的仪器、操作及现象)。
|
序号 |
实验目的 |
实验方法 |
|
① |
检验混合气体N2和NH3中有NH3 |
|
|
② |
除去NaCl和NH4Cl固体混合物中的杂质NH4Cl |
|
|
③ |
观察铜与浓硫酸在试管中共热后产物溶液的颜色 |
|
【答案】
|
序号 |
实验方法 |
|
① |
用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生 (2分) |
|
② |
把固体置于蒸发皿中加热至不再产生气体 (2分) |
|
③ |
待反应液冷却后,把液体小心沿器壁倒入装有水的敞口容器中,边倒边用玻璃棒搅拌(2分) |
【解析】考查常见的基本实验操作。氨气属于碱性气体,可用湿润的红色湿润试纸或蘸有浓盐酸的玻璃棒来检验。铵盐不稳定,受热易分解,所以可以通过加热的方法除去氯化铵。因为溶液中还有浓硫酸,所以在观察溶液颜色时,需要首先进行稀释。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
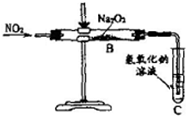 NO2与Na2O2常温下能反应.反应时何者为氧化剂?两同学开展如下研究.
NO2与Na2O2常温下能反应.反应时何者为氧化剂?两同学开展如下研究.【作出猜想】甲乙同学对反应如何进行有如下猜想:
猜想一:Na2O2+2NO2=2NaNO2+O2↑
猜想二:2Na2O2+4NO2=4NaNO3
【查阅资料】2Na2O2+2H2O=4NaOH+O2↑
2NO2+2NaOH=NaNO2+NaNO3+H2O
2NaNO2+2HCl=2NaCl+NO↑+NO2↑+H2O
【实验探究】a.按图示实验装置开展实验.实验时,往装置中通入足量的NO2,直至反应停止;b.取反应后玻璃直管中固体物质于试管中进行如下实验,并观察、记录现象:
| 实验操作 | 实验现象 |
回答下列问题:
(1)实验时,利用铜与浓硝酸制取NO2,反应方程式为
(2)装置C的作用是
(3)根据实验结论,NO2与Na2O2反应时作氧化剂的物质是
(4)请根据实验目的要求和实验结论,将“实验探究”栏目中的表格填写完整.
(5)甲乙同学都认为,不宜直接观察C装置导管口是否有气泡冒出即可判断Na2O2与NO2反应究竟按哪种猜想进行.其原因是
(6分)请根据实验目的填写简要的实验方法(包括使用的仪器、操作及现象)。
| 序号 | 实验目的 | 实验方法 |
| ① | 检验混合气体N2和NH3中有NH3 |
|
| ② | 除去NaCl和NH4Cl固体混合物中的杂质NH4Cl |
|
| ③ | 观察铜与浓硫酸在试管中共热后产物溶液的颜色 |
|
(6分)请根据实验目的填写简要的实验方法(包括使用的仪器、操作及现象)。
| 序号 | 实验目的 | 实验方法 |
| ① | 检验混合气体N2和NH3中有NH3 | |
| ② | 除去NaCl和NH4Cl固体混合物中的杂质NH4Cl | |
| ③ | 观察铜与浓硫酸在试管中共热后产物溶液的颜色 | |
