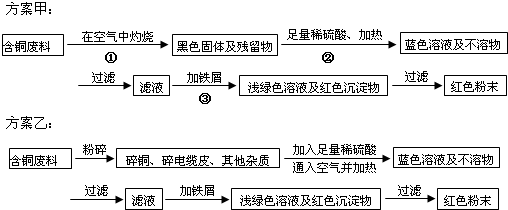
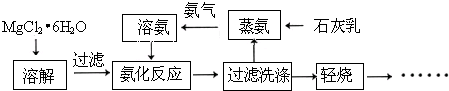
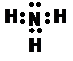题目内容
(2012?珠海一模)设NA为阿伏加德罗常数,下列说法正确的是( )
分析:A、依据通常情况下,氯化钠是离子化合物,无分子存在分析判断;
B、依据气体摩尔体积的条件应用分析判断;
C、依据过氧化钠与水反应是过氧化钠自身的氧化还原反应计算电子转移数;
D、依据碳酸根离子水溶液中水解分析判断;
B、依据气体摩尔体积的条件应用分析判断;
C、依据过氧化钠与水反应是过氧化钠自身的氧化还原反应计算电子转移数;
D、依据碳酸根离子水溶液中水解分析判断;
解答:解:A、通常条件下,氯化钠是离子化合物,由阴阳离子构成无分子存在,故A错误;
B、常温常压下,2.24LC2H4物质的量不是0.1mol,所以含有共用电子对的数目不是0.6NA;故B错误;
C、Na2O2与足量的水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2,每2molNa2O2反应转移电子物质的量为2mol,所以0.1mol过氧化钠反应电子转移为0.1mol,故C错误;
D、200mL0.5mol?L-1的Na2CO3溶液中碳酸钙离子物质的量为0.1mol,但由于碳酸根离子水解,所以含碳酸根离子物质的量小于0.1NA,故D正确;
故选D.
B、常温常压下,2.24LC2H4物质的量不是0.1mol,所以含有共用电子对的数目不是0.6NA;故B错误;
C、Na2O2与足量的水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2,每2molNa2O2反应转移电子物质的量为2mol,所以0.1mol过氧化钠反应电子转移为0.1mol,故C错误;
D、200mL0.5mol?L-1的Na2CO3溶液中碳酸钙离子物质的量为0.1mol,但由于碳酸根离子水解,所以含碳酸根离子物质的量小于0.1NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查离子化合物的结构,气体摩尔体积的条件应用,氧化还原反应的电子转移数计算,盐类水解的应用.

练习册系列答案
相关题目