题目内容
常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
|
序号 |
a |
b |
c |
d |
e |
f |
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
NaAlO2 |
|
pH |
8. 8 |
9. 7 |
11. 6 |
10. 3 |
11. 1 |
11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为 。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是 (用离子方程式表示)。将溶液加热蒸干最后得到的固体产物是 ;
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有 (填字母代号)。
A.pH=8. 8的NaOH溶液 B. pH=5. 2的NH4Cl溶液 C.pH=5. 2的盐酸
D. 0. 1 mol/L的NaCN溶液 E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有 。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B. 2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C. c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D. c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为 。
(1)CH3COO-
(2)AlO- +2H2O
 Al(OH)3+OH- ,
NaAlO2
Al(OH)3+OH- ,
NaAlO2
(3) BE (4)BDE (5)c(Cl- )>c(Na+)>c(Al3+)>c(H+)>c(OH- )
【解析】
试题分析:
(1)相同浓度的钠盐溶液,pH越小则盐的水解程度越小,阴离子结合H+能力最弱的就是弱酸根对应的酸酸性最强的。酸性强弱CH3COOH>H2CO3>HClO>HCN>HAlO2,所以阴离子结合H+能力最弱的为CH3COO-。
(2)NaAlO2是强碱弱酸盐,AlO-水解使溶液显碱性,AlO- +2H2O Al(OH)3+OH- , NaAlO2水解生成NaOH和Al(OH)3,二者均不易分解和挥发,所以将溶液加热蒸干最后得到的固体产物是NaAlO2 。
Al(OH)3+OH- , NaAlO2水解生成NaOH和Al(OH)3,二者均不易分解和挥发,所以将溶液加热蒸干最后得到的固体产物是NaAlO2 。
(3)0.1mol/L的CH3OONa溶液,促进水的电离,水电离的c(OH-)=10−14 /10−8.8 =10-5.2mol/L
A.pH=8.8的NaOH溶液,抑制水的电离,水电离的c(H+)=10-8.8mol/L;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离的c(H+)=10-5.2mol/L;
C.pH=5.2的盐酸,抑制水的电离,水电离的c(OH-)=10−14 /10−5.2 =10-8.8mol/L;
D.0.1mol/L的NaCN溶液,促进水的电离,水电离的c(H+)=10-11.1mol/L;
E.pH=8.8的Na2CO3溶液,促进水的电离,水电离的c(OH-)=10−14 /10−8.8 =10-5.2mol/L;
所以与0.1mol/L的CH3OONa溶液中水的电离程度相同的是:BE;故答案为:BE;
(4)将浓度均为0. 1 mol/L的NaHCO3、Na2CO3等体积混合,混合溶液中粒子之间符合电荷守恒,物料守恒和质子守恒。NaHCO3溶液有物料守恒:c(Na+)=c(CO32-) +c(HCO3-) +c(H2CO3);Na2CO3溶液有c(Na+)=2c(CO32-) +2c(HCO3-) +2c(H2CO3;二式相加即2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3;B正确。电荷守恒c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)D正确; CO32- 水解程度大于HCO3-,溶液呈碱性,所以有c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+) ,E正确。
考点:本题考查盐类水解素、化学平衡的影响因素、

 阅读快车系列答案
阅读快车系列答案

 )2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。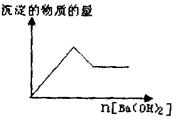
 存在的离子有 ;
存在的离子有 ;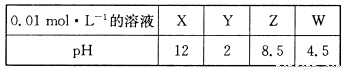
 复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。 NaHCO3+C6H5OH
NaHCO3+C6H5OH Na2CO3+2C6H5OH
Na2CO3+2C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa