题目内容
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42-,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:
(1)检验吸收液中的SO42-: ,证明Fe3+能够把H2SO3氧化成SO42-.
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ ═ +H2SO4+ ,反应中的氧化产物是 (写化学式).
(1)检验吸收液中的SO42-:
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+
考点:氧化还原反应方程式的配平,硫酸根离子的检验
专题:
分析:(1)硫酸根离子和钡离子反应生成白色沉淀,但要排除亚硫酸根离子的干扰;
(2)该反应中S元素化合价由+4价变为+6价,二氧化硫作还原剂,FeCl3作氧化剂,得电子化合价降低,因为生成物中含有硫酸,所以氯化铁被还原生成亚铁盐,根据元素守恒,反应物中有水参加,同时生成物中还生成HCl.
(2)该反应中S元素化合价由+4价变为+6价,二氧化硫作还原剂,FeCl3作氧化剂,得电子化合价降低,因为生成物中含有硫酸,所以氯化铁被还原生成亚铁盐,根据元素守恒,反应物中有水参加,同时生成物中还生成HCl.
解答:
解:(1)硫酸根离子和钡离子反应生成白色沉淀,但要排除亚硫酸根离子的干扰,其检验方法是:取少量溶液倒入试管中,向试管中先加入少量稀盐酸,然后向溶液中加入氯化钡溶液,如果产生白色沉淀,就说明含有硫酸根离子,否则没有硫酸根离子,故答案为:取少量溶液倒入试管中,向试管中先加入少量稀盐酸,然后向溶液中加入氯化钡溶液,观察是否有白色沉淀生成;
(2)该反应中S元素化合价由+4价变为+6价,二氧化硫作还原剂,FeCl3作氧化剂,得电子化合价降低,因为生成物中含有硫酸,所以氯化铁被还原生成亚铁盐,根据元素守恒知,反应物中有水参加,同时生成物中还生成HCl,转移电子数为2,则该反应方程式为2FeCl3+SO2+2H2O═2FeCl2+H2SO4+2HCl,该反应中H2SO4是氧化产物,故答案为:2H2O;2FeCl2;2HCl;H2SO4.
(2)该反应中S元素化合价由+4价变为+6价,二氧化硫作还原剂,FeCl3作氧化剂,得电子化合价降低,因为生成物中含有硫酸,所以氯化铁被还原生成亚铁盐,根据元素守恒知,反应物中有水参加,同时生成物中还生成HCl,转移电子数为2,则该反应方程式为2FeCl3+SO2+2H2O═2FeCl2+H2SO4+2HCl,该反应中H2SO4是氧化产物,故答案为:2H2O;2FeCl2;2HCl;H2SO4.
点评:本题考查氧化还原反应方程式的配平和硫酸根离子检验,根据转移电子守恒、原子守恒配平方程式,知道常见离子的检验方法及现象,要注意排除干扰离子,会运用化学用语描述实验现象,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质中,都属于强电解质的一组是( )
| A、HBr、HCl、BaSO4 |
| B、NH4Cl、CH3COOH、Cu |
| C、NaOH、CO2、NH3?H2O |
| D、HClO、Na2S、Ba(OH)2 |
下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
A、2NaCl(s)+H2SO4(浓)
| ||||
B、C+2H2SO4(浓)
| ||||
C、Cu+2H2SO4(浓)
| ||||
D、2FeO+4H2SO4(浓)
|
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述观点,下列说法中不正确的是( )
| A、CaO2的水解产物是Ca(OH)2和H2O2 |
| B、Al4C3的水解产物是Al(OH)3和甲烷 |
| C、PCl3的水解产物是PH3和HClO |
| D、A1(C2H5)3的水解产物是Al(OH)3与C2H6 |
在25℃时,将两个铂电极插入到一定量的Na2SO4饱和溶液中电解,通电一段时间后,在阴极逸出a mol气体,同时有Wg Na2SO4.10H2O晶体析出.若温度不变,此时剩余Na2SO4溶液的质量分数为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列不属于氧化还原反应的是( )
| A、铁与水蒸气反应 |
| B、Na2O2与水反应 |
| C、AlCl3溶液中滴加氨水 |
| D、自然界中“氮的固定” |




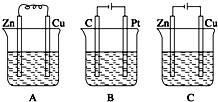 如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.