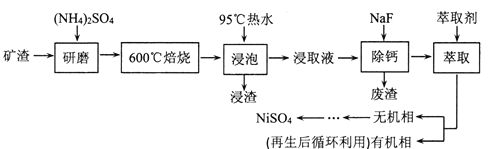
题目内容
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L0.1molL﹣1CH3COOH溶液中加入0.1molCH3COONa固体,平衡后则溶液中![]() ___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
(2)常温下向20mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
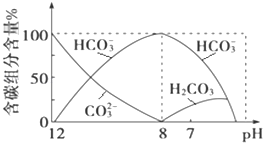
回答下列问题:
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣___(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有_____、___,溶液中含量最多的三种微粒的物质的量浓度的大小关系为____;
③已知在25℃时,CO32﹣水解反应的平衡常数即水解常数Kh═2×10﹣4 molL﹣1,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,溶液的pH=_____。
【答案】不变 c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+) 不能 HCO3﹣ H2CO3 c(Na+)>c(Cl﹣)>c(HCO3﹣) 10
【解析】
(1)Ka=![]() 只与温度有关;溶液中存在电荷守恒;
只与温度有关;溶液中存在电荷守恒;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水;
①根据图像可知,pH=8时溶液中主要为碳酸氢根离子,pH大于8时存在碳酸根离子和碳酸氢根离子离子,pH小于8时存在碳酸和碳酸氢根离子,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存;
②根据图像pH=7时,溶液中存在的离子主要为:H2CO3、HCO3-,溶液显示中性,c(H+)=c(OH-),此时加入盐酸的体积大于20mL小于40mL,溶液中溶质为碳酸氢钠、氯化钠及碳酸,由此判断溶液中主要微粒浓度大小关系;
③水解常数Kh=![]() ,当溶c(HCO3-):c(CO32-)=2:1时,根据水解常数计算c(OH-),由水的离子积Kw计算c(H+),根据pH=-lgc(H+)计算。
,当溶c(HCO3-):c(CO32-)=2:1时,根据水解常数计算c(OH-),由水的离子积Kw计算c(H+),根据pH=-lgc(H+)计算。
(1)一定温度下,向1L 0.1molL﹣1CH3COOH溶液中加入0.1mol CH3COONa固体,由于温度不变,Ka=![]() 只与温度有关,所以
只与温度有关,所以![]() 不变;溶液中存在电荷守恒为:c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+);
不变;溶液中存在电荷守恒为:c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+);
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成碳酸(部分碳酸分解成二氧化碳)、水;
①由反应及图象可知,在同一溶液中,H2CO3、HCO3﹣、CO32﹣不能大量共存;
②由图象可知,pH=7时,溶液中含碳元素的主要微粒为HCO3﹣、H2CO3,溶液显示中性,溶液中c(H+)=c(OH-),此时加入盐酸的体积大于20mL小于40mL,发生的反应有Na2CO3+HCl=NaHCO3+NaCl(Na2CO3完全反应)、NaHCO3+HCl=NaCl+H2CO3(NaHCO3部分反应),溶液中溶质为碳酸氢钠、氯化钠(NaCl浓度大于碳酸氢钠浓度)及碳酸,则溶液中含量最多的三种微粒的物质的量浓度的大小关系为c(Na+)>c(Cl﹣)>c(HCO3﹣);
③CO32﹣的水解常数Kh=![]() =2×10﹣4,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,c(OH﹣)=10﹣4mol/L,由Kw可知,c(H+)=10﹣10mol/L,所以pH=10。
=2×10﹣4,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,c(OH﹣)=10﹣4mol/L,由Kw可知,c(H+)=10﹣10mol/L,所以pH=10。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①乙酸 ②苯酚 ③碳酸 ④乙醇
I.甲同学设计并实施了如下实验方案。
编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①③溶液 | 略 |
2 | 将CO2通入C6H5ONa溶液中 | 方程式:______________。 | |
3 | 配制等物质的量浓度的CH3COONa、 NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于 CH3COONa溶液 | 略 |
4 | 向含酚酞的NaOH溶液中,各滴加等量的②④两种溶液 | ④中无明显现象 ②中红色明显变浅 | 滴加②时方程式:______。 |
结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)______________。 | |||
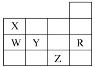
II.乙同学对甲同学的实验提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)D中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有________溶液的洗气装置,使乙同学的实验设计更加完善。