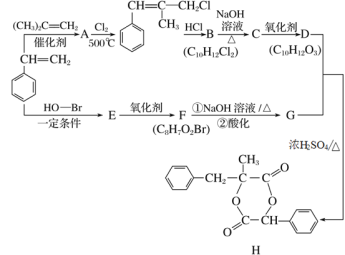
��Ŀ����
����Ŀ��������һ�־���ǿ�����ԡ���ʴ�Ե�ǿ�ᣬ�仹ԭ����������Ũ�ȵIJ�ͬ���б仯����������˵������Ũ��Խ�ߣ�ƽ��ÿ��������õ��ĵ�����Խ�٣�Ũ����Ļ�ԭ������ҪΪNO2��ϡ����Ļ�ԭ����ΪNO��ʵ�����У�����Cu��ŨHNO3��Ӧ��ȡNO2����Cu��ϡHNO3��Ӧ��ȡNO��
(1)��д��ʵ��������Cu��ϡHNO3��Ӧ��ȡNO�Ļ�ѧ����ʽ����˫���ű������ӵ�ת�Ʒ�����Ŀ_________________
(2)64gCu��������ŨHNO3��Ӧ��ͭȫ�����ú��ռ���22.4L����(��״����)����Ӧ�����ĵ�HNO3�����ʵ�����_________(����ĸ����)��
A.0.5mol B. 1.0mol C. 2.0mol D. 3.0mol
����������ֱ���_______________�������ʵ���֮����_______________
(3)ʵ����������ɱ���ԭΪNO2��NO��Ũ�ȸ�ϡʱ���ỹ���Ա���ԭΪN2O��N2��NH4NO3�ȣ��뽫����3�����ʣ�FeSO4��Fe(NO3)3��Fe2(SO4)3�ֱ����������Ӧ�ĺ����ϣ�����ƽ�÷�Ӧ�Ļ�ѧ����ʽ��___HNO3+_______�� _______+ _______ +___ NO��+___H2O
(4)����Ļ�ԭ����NO��NO2��N2O�ȶԻ������и����ã�Ϊ�˿ɳ�����չ��������������һ���¸���--����ɫ��ѧ������Ҫ��Ӿ��á������ͼ�������ƿ��еĻ�ѧ��Ӧ���������ɵ���ͭ��ȡ����ͭ�ķ��������ҷ��ϡ���ɫ��ѧ������_______(����ĸ����)��
A��Cu![]() Cu(NO3)2
Cu(NO3)2
B��Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C��Cu![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2![]() Cu(NO3)2
Cu(NO3)2
D��Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
���𰸡�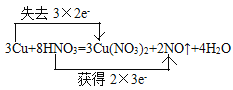 D NO2��NO 1:1 4 3FeSO4 Fe(NO3)3 Fe2(SO4)3 1 2 B
D NO2��NO 1:1 4 3FeSO4 Fe(NO3)3 Fe2(SO4)3 1 2 B
��������
(1)Cu��ϡHNO3��Ӧ��д����ͭ��NO��ˮ������Ԫ�ػ��ϼ����ߵ����ʷ���������Ӧ���������õ����ӣ������������������NԪ�ػ��ϼ۱仯����ת�Ƶ��ӣ�
(2)Cu�����ᷴӦ����Cu(NO3)2��NO2��NO������CuԪ���غ����n[Cu(NO3)2]������NԪ���غ���㷴Ӧ������HNO3�����ʵ�����
(3)�����������У�HNO3�е�Ԫ�ػ��ϼ�λ����ۣ����������ԣ���Ӧ��ԭ����ΪNO���ܽ���ԭ�Ե�FeSO4����ΪFe2(SO4)3��Fe(NO3)3�����ݵ���ת���غ㡢����غ㡢ԭ���غ���ƽ���ӷ���ʽ��
(4)A��ͭ�����ᷴӦ�����һ������������������
B��NԪ�ر���ȫ���ã�û����Ⱦ�����ɣ���;��������ɫ��ѧԭ����
C������ͭ��ˮ����Ӧ��
D��ͭ��ϡ�����Ӧ�������Ƶ�����ͭ��ͭ��Ũ���ᷴӦ����������������塣
(1) Cu��ϡHNO3��Ӧ��������ͭ��һ��������ˮ����ѧ����ʽΪ��3Cu+8HNO3(Ũ)= 3Cu(NO3)2+2NO��+4H2O���÷�Ӧ�У�ͭԪ���ɷ�Ӧǰ����Cu��0�۱�Ϊ��Ӧ��Cu(NO3)2�е�+2�ۣ����ϼ����ߣ�ʧȥ2e-������������Ӧ��NԪ�صĻ��ϼ��ɷ�Ӧǰ�����е�+5�۱�Ϊ��Ӧ��NO�е�+2�����ϼ۽��ͣ����3e-�����ӵ�ʧ��С��������6������Cu��Cu(NO3)2��ϵ��Ϊ3��HNO3��NO��ϵ��Ϊ2�����ڻ���3��Cu(NO3)2�е�6��NO3-û�вμ�������ԭ��Ӧ��Ҳ���������ṩ������HNO3��ϵ����Ϊ2+6=8������HԪ��ԭ���غ㣬��֪ˮ��ϵ��Ϊ4������ʽΪ3Cu+8HNO3=3Cu(NO3)2+2NO��+4H2O ����˫���ŷ���ʾΪ��
 ��
��
(2)n(Cu)=1mol����n[Cu(NO3)2]=1mol��n(NO2)+n(NO)= 22.4L�� 22.4L/mol=1mol��������ԭ����������ʵ���Ϊ1mol������n[Cu(NO3)2]=1mol��֪δ�μ�������ԭ��Ӧ������Ϊ���Ե���������ʵ���Ϊ2mol���ʷ�Ӧ��������������ʵ���Ϊn(HNO3)=1mol+2mol=3mol������ѡ����D��
��Ӧ��Cu���ʵ�����1mol��ʧȥ2mol���ӣ���ʼ����ΪŨ���ᣬ����ԭ����NO2�����ŷ�Ӧ�Ľ��У������Ϊϡ���ᣬ���ᱻ��ԭ��ΪNO������NO2���ʵ���Ϊx����NO���ʵ���Ϊ(1-x)�����ݵ����غ㣬�ɵ�x+3(1-x)=2�����x=0.5mol��1-x=0.5mol���ʶ��ߵ����ʵ����ı�Ϊ1��1��
(3)�����������У�HNO3�е�Ԫ�ػ��ϼ�λ����ۣ����������ԣ���Ӧ��ԭ����ΪNO���ܽ���ԭ�Ե�FeSO4����ΪFe2(SO4)3��Fe(NO3)3�����ݵ����غ㡢ԭ���غ㣬�ɵ÷����ķ�ӦΪ��4HNO3+3FeSO4��Fe(NO3)3+ Fe2(SO4)3+NO��+2H2O��
(4)A��ͭ�����ᷴӦ�����һ�����������������ȴ�����Ⱦ�A����
B��NԪ�ر���ȫ���ã�û����Ⱦ�����ɣ���;��������ɫ��ѧԭ����B��ȷ��
C��������������ͭ��ˮ����Ӧ�������Ƶ�����ͭ��C����
D����;����ͭ��ϡ�����Ӧ�������Ƶ�����ͭ��ͭ��Ũ���ᷴӦ����������������壬��Ⱦ������D����
�ʺ���ѡ����B��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��N2O5��һ��������������һ���¶��·�����Ӧ2N2O5(g)4NO2(g)��O2(g)����H>0, T1�¶��µIJ���ʵ���������±���ʾ��
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
����˵����ȷ����
A. �÷�Ӧ���κ��¶��¾����Է�����
B. T1�¶��µ�ƽ�ⳣ��ΪK1��125��1 000 sʱN2O5(g)ת����Ϊ50%
C. ������������ʱ��T2�¶��·�Ӧ��1 000 sʱ���N2O5(g)Ũ��Ϊ2.98 mol/L����T1<T2
D. T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1>T2����K1<K2