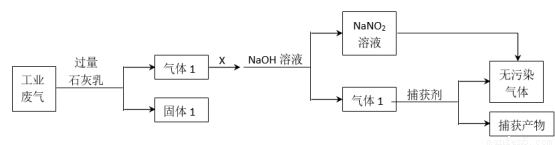
题目内容
在常温下,0.10mol·L-1Na2CO3溶液25mL 用0.10mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
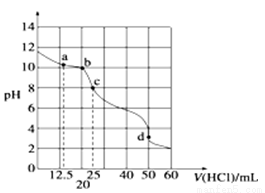
A.a点:c(CO2-3)=c(HCO-3)>c(OH-)
B.b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3)
C.c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3)
D.d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-)
练习册系列答案
相关题目
6.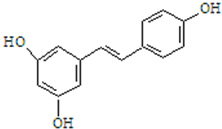 白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )
白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )
 白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )
白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )| A. | 该有机物属于醇类 | |
| B. | 1mol该有机物与H2加成时最多消耗1mol H2 | |
| C. | 1mol该有机物与Br2反应时最多消耗6mol Br2 | |
| D. | 1mol该有机物最多消耗3mol NaOH |
7.下列物质中含有两种官能团的是( )
| A. | 四氯甲烷(CCl4) | B. | 甘油 | C. | 乙烷(CH3CH3) | D. | 氯乙烯(CH2═CHCl) |
4.结构简式为 的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )
的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )
 的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )
的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
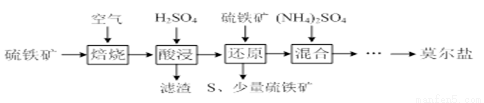
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是____________,写出“还原”时反应Ⅱ的离子方程式:___________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)。
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.2 | 3.5 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式__________。
18.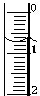 某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
一.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,且半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
二.实验记录:
Ⅲ.数据处理与讨论:
(5)市售白醋总酸量=4.500g/100mL.
 某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).一.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,且半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
二.实验记录:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)市售白醋总酸量=4.500g/100mL.