题目内容
【题目】铁及其化合物有重要用途,如聚合硫酸铁 是一种新型高效的水处理混凝剂,而高铁酸钾
是一种新型高效的水处理混凝剂,而高铁酸钾![]() 其中铁的化合价为
其中铁的化合价为![]() 是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
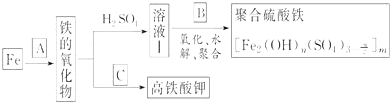
请回答下列问题:
![]() 若A为
若A为![]() ,写出反应方程式:______.
,写出反应方程式:______.
![]() 若B为
若B为![]() 与稀硫酸,写出其氧化
与稀硫酸,写出其氧化![]() 的离子方程式
的离子方程式![]() 还原产物为
还原产物为![]() ______.
______.
![]() 若C为
若C为![]() 和KOH的混合物,写出其与
和KOH的混合物,写出其与![]() 加热共融制得高铁酸钾
加热共融制得高铁酸钾![]() 的化学方程式,并配平:
的化学方程式,并配平:
![]() ______
______![]() ______
______
![]() 为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取
为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取![]() 溶液Ⅰ于带塞锥形瓶中,,加入足量
溶液Ⅰ于带塞锥形瓶中,,加入足量![]() ,调节
,调节![]() ,加热除去过量
,加热除去过量![]() ;加入过量KI充分反应后,再用
;加入过量KI充分反应后,再用![]() 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液![]() 。
。
已知:
![]()
![]()
滴定选用的指示剂及滴定终点观察到的现象______.溶液Ⅰ中铁元素的总含量为______![]() 若滴定前溶液中
若滴定前溶液中![]() 没有除尽,所测定的铁元素的含量将会______
没有除尽,所测定的铁元素的含量将会______![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() .
.
【答案】![]()
![]()
![]()
![]()
![]() 、3、2
、3、2 ![]()
![]()
![]() 偏高
偏高
【解析】
(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气;
(2)溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平;
(3)若C为KNO3和KOH的混合物,与Fe2O3加热共融制得高铁酸钾,则缺项物质为K2FeO4和H2O,根据得失电子相等、质量守恒配平;
(4)反应原理中有碘单质生成和消耗,碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色,据此判断滴定终点;根据反应2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-找出关系式Fe3+~S2O32-,然后根据关系式计算出铁离子的物质的量,再根据c=![]() 计算出铁元素含量;根据双氧水对消耗S2O32-的物质的量的影响判断误差。
计算出铁元素含量;根据双氧水对消耗S2O32-的物质的量的影响判断误差。
![]() 与水蒸气在高温下反应的化学方程式为:
与水蒸气在高温下反应的化学方程式为:![]()
![]()
![]() ;
;
![]() 根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,
根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,![]() 氧化
氧化![]() 为
为![]() ,本身被还原为
,本身被还原为![]() 。根据化合价升降相等配平,配平后的离子方程式为:
。根据化合价升降相等配平,配平后的离子方程式为:![]() ;
;
![]() 和KOH的混合物,写出其与
和KOH的混合物,写出其与![]() 加热共融制得
加热共融制得 ,则缺项中有一种为
,则缺项中有一种为![]() ,
,![]() 中铁元素化合价为
中铁元素化合价为![]() ,则亚铁离子从
,则亚铁离子从![]() 价变为
价变为![]() 价,化合价升高3价,化合价至少升高
价,化合价升高3价,化合价至少升高![]() 价;
价;![]() 中N元素从
中N元素从![]() 降为
降为![]() 中的
中的![]() 价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,
价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,![]() 的系数为3,然后根据质量守恒定律配平,配平后的方程式为:
的系数为3,然后根据质量守恒定律配平,配平后的方程式为:![]() ;
;
![]() 氧化
氧化![]() 生成
生成![]() ,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,,蓝色消失,且半分钟不变色说明是终点;
,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,,蓝色消失,且半分钟不变色说明是终点;
![]() 由
由![]() 、
、![]() 可得:
可得:![]() ,则
,则![]() ,铁元素总含量为:
,铁元素总含量为:![]() ;
;
![]() 也能氧化
也能氧化![]() 生成
生成![]() ,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高。
,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高。