题目内容
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验.写出制取Cl2的离子方程式
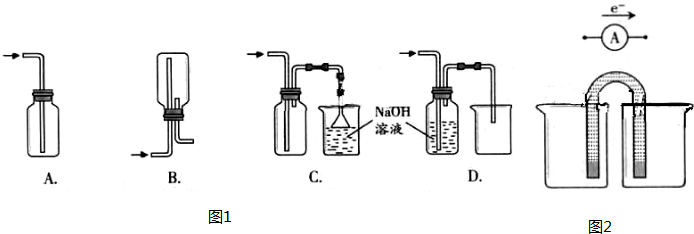
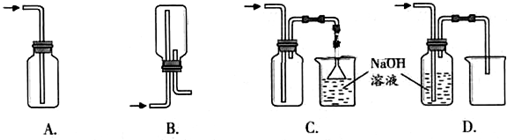
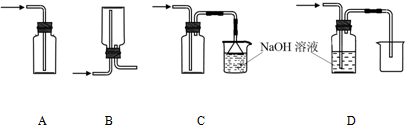
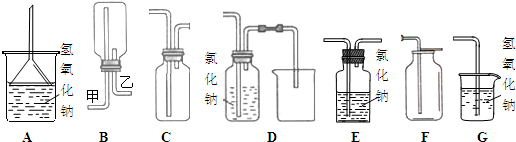
(2)下图A~G都是常见的与气体制备、收集、尾气吸收有关的装置.例如,B、C都可以收集H2、CH4、NH3、Cl2等.如果收集Cl2并进行尾气处理,不能选用
(3)工业常用Cl2从海水中制备Br2,反应离子方程式是
(4)次氯酸盐有强氧化性,如NaClO可以氧化NH3制备高能燃料N2H4,反应方程式是:
分析:(1)根据浓盐酸和二氧化锰的性质判断生成物,从而确定方程式;从该混合物中回收MnO2并提取MnCl2晶体,需通过①溶解:用玻璃棒搅拌;②过滤:用玻璃棒引流;③蒸发:用玻璃棒搅拌,避免液体局部过热造成液滴飞溅;
(2)根据制取气体的药品和条件来选择仪器和装置;氯气制备是固体和液体加热制备气体,氯气难溶于饱和食盐水,可用排饱和食盐水的方法收集氯气;氯气有毒不能直接用排空气法收集;氯气的密度比空气大,可用向上排空气法收集;
(3)氯气具有氧化性,能氧化溴离子生成单质溴;根据分液操作进行解答,四氯化碳密度比水大;
(4)依据氧化还原反应电子守恒分析判断产物和配平化学方程式,并依据方程式进行计算.
(2)根据制取气体的药品和条件来选择仪器和装置;氯气制备是固体和液体加热制备气体,氯气难溶于饱和食盐水,可用排饱和食盐水的方法收集氯气;氯气有毒不能直接用排空气法收集;氯气的密度比空气大,可用向上排空气法收集;
(3)氯气具有氧化性,能氧化溴离子生成单质溴;根据分液操作进行解答,四氯化碳密度比水大;
(4)依据氧化还原反应电子守恒分析判断产物和配平化学方程式,并依据方程式进行计算.
解答:解:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,二氧化锰、氯气、水在离子反应中应保留化学式,离子反应方程式为:MnO2+2Cl-+4H+
Cl2↑+Mn2++2H2O,从该混合物中回收MnO2并提取MnCl2晶体,需通过过滤操作,滤渣为MnO2,具体操作为:①溶解,为了加速溶解而用玻璃棒搅拌;②过滤,过滤过程中为了防止液体外流而用玻璃棒引流;③蒸发,蒸发时为了避免液体局部过热造成液滴飞溅而用玻璃棒搅拌,
故答案为:MnO2+2Cl-+4H+
Cl2↑+Mn2++2H2O; 玻璃棒;
(2)氯气制备是固体和液体加热制备气体,可以通过饱和食盐水方法收集氯气,A可收集氯气的尾气,并能防止倒吸;B、C都可以收集Cl2;D无法将氯化钠溶液排到烧杯中,故D不符合;E从短口进氯气,可用排饱和食盐水的方法收集氯气;氯气有毒不能直接用排空气法收集,故F不符合,G用于吸收氯气;氯气比空气重,用向上排气法收集Cl2,如用B收集,需从乙口进氯气,
故答案为:DF;乙;
(3)氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-=Br2+2Cl-,取混合溶液于分液漏斗中,加入CCl4,振荡,溶液由无色变为橙黄色,溶液分层,上层液体几乎为无色,下层液体为橙红色,为溴的四氯化碳溶液,从分液漏斗下端放出有机层,(从上端倒出水层),
故答案为:Cl2+2Br-=2Cl-+Br2;从分液漏斗下端放出有机层,(从上端倒出水层);
(4)NH3与NaClO反应得到肼(N2H4),氮元素化合价升高被氧化,次氯酸钠做氧化剂被还原为氯化钠,依据原子守恒配平写出化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,现有14.9g NaClO,n(NaClO)=
=
=0.2mol,由方程式可知,最多可以制备0.2molN2H4,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;0.2.
| ||
故答案为:MnO2+2Cl-+4H+
| ||
(2)氯气制备是固体和液体加热制备气体,可以通过饱和食盐水方法收集氯气,A可收集氯气的尾气,并能防止倒吸;B、C都可以收集Cl2;D无法将氯化钠溶液排到烧杯中,故D不符合;E从短口进氯气,可用排饱和食盐水的方法收集氯气;氯气有毒不能直接用排空气法收集,故F不符合,G用于吸收氯气;氯气比空气重,用向上排气法收集Cl2,如用B收集,需从乙口进氯气,
故答案为:DF;乙;
(3)氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-=Br2+2Cl-,取混合溶液于分液漏斗中,加入CCl4,振荡,溶液由无色变为橙黄色,溶液分层,上层液体几乎为无色,下层液体为橙红色,为溴的四氯化碳溶液,从分液漏斗下端放出有机层,(从上端倒出水层),
故答案为:Cl2+2Br-=2Cl-+Br2;从分液漏斗下端放出有机层,(从上端倒出水层);
(4)NH3与NaClO反应得到肼(N2H4),氮元素化合价升高被氧化,次氯酸钠做氧化剂被还原为氯化钠,依据原子守恒配平写出化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,现有14.9g NaClO,n(NaClO)=
| m |
| M |
| 14.9g |
| 74.5g/mol |
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;0.2.
点评:本题考查了制备氯气实验装置的分析判断,主要是收集装置的装置选择,注意掌握分液操作,题目难度中等.

练习册系列答案
相关题目
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.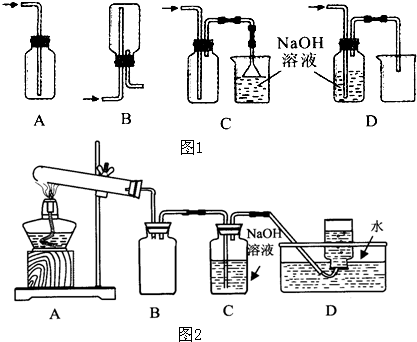
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验,如图1所示.
①写出该反应的离子方程式 ;
②下列收集Cl2的装置正确装置是 ;
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 ;
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, .
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验.
用如图2所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
①装置B的作用是 .
②经小组讨论并验证该无色气体为O2,其验证方法是 .
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:ⅠAg;ⅡAg2O;ⅢAg和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
【实验评价】根据上述实验,③不能确定固体产物成分的实验是 (填实验编号).
【实验结论】根据上述实验结果,④该小组得出的AgNO3固体热分解的化学方程式为 .

(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验,如图1所示.
①写出该反应的离子方程式
②下列收集Cl2的装置正确装置是
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验.
用如图2所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
①装置B的作用是
②经小组讨论并验证该无色气体为O2,其验证方法是
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:ⅠAg;ⅡAg2O;ⅢAg和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,④该小组得出的AgNO3固体热分解的化学方程式为