题目内容
【题目】25 ℃时,H3A水溶液(一种酸溶液)中含A的各种粒子的分布分数[平衡时某种粒子的浓度占各种粒子浓度之和的分数(α)]与pH的关系如图所示。下列叙述正确的是( )
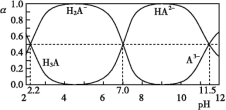
A.根据图,可得Ka1(H3A)≈10-7
B.将等物质的量的NaH2A和Na2HA混合物溶于水,所得的溶液中α(H2A-)=α(HA2-)
C.以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入H3A溶液中,当溶液由无色变为浅红色时停止滴加,则生成NaH2A
D.在上述含A的各种粒子的体系中,若溶液pH为11.5时,则c(H2A-)+5c(A3-)+c(OH-)=c(H+)
【答案】B
【解析】
A.Kal(H3A)= ,如果c(H2A-)=c(H3A),则Kal(H3A)=c(H+ )=10-2.2,故A错误;
,如果c(H2A-)=c(H3A),则Kal(H3A)=c(H+ )=10-2.2,故A错误;
B.将等物质的量的NaH2A和Na2HA混合物溶于水,初始时溶液中c(H2A-)=c(HA2-),由于H2A-存在电离和水解,HA2-也存在电离和水解,由于Ka2(H3A)=10-7,则H2A-的电离程度等于水解程度,溶液呈中性,根据图象反应的是平衡浓度的关系,则有α(H2A- )=α(HA 2- ),故B正确;
C.将NaOH溶液逐滴加入到H3A溶液中,当溶液由无色变为浅红色时停止滴加,溶液的pH在8.2-10.0,若此时生成NaH2A,由于Ka2(H3A)=10-7,则H2A-的电离程度等于水解程度,溶液呈中性,不到酚酞变色范围,故C错误;
D.溶液pH为11.5时,根据图象,溶液中c(HA2-)=c(A3-),由于溶液为碱性,则溶液中c(OH-)>c(H+),故D错误,
故选:B。

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目



