题目内容
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式_________________________________________。
②由上表数据可知该反应为放热反应,理由是_____________________________________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g) + H2O (g)
 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的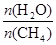 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: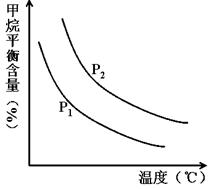
①图中,两条曲线表示压强的关系是:P1________P2(填“>”、“=”或“<”)。
②该反应为_____________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g)
 CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为______,该温度下反应的平衡常数K值为_________。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____________(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
(1)①N2 + 3H2 2 NH3(2分) ② 随温度升高,反应的平衡常数K减小(2分)
2 NH3(2分) ② 随温度升高,反应的平衡常数K减小(2分)
③a、d(2分) (2)①<(2分)②吸热(2分)
(3)①60 %(2分) 9/4或2.25(2分) ②c和d(2分)
解析试题分析:(1)①工业上利用氮气和氢气在一定条件下发生化合反应制备氨气,所以工业合成氨的化学方程式为N2 + 3H2 2 NH3。
2 NH3。
②根据表中数据可知,随着温度的逐渐升高,平衡常数逐渐减小。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应。
③合成氨是体积减小的放热的可逆反应,则a、增大压强,平衡向正反应方向移动,氢气的转化率增大,a正确;b、催化剂只能改变反应速率,而不能改变平衡状态,所以使用合适的催化剂不能改变氢气的转化率,b不正确;c、升高温度,平衡向逆反应方向移动,氢气的转化率降低,c不正确;d、及时分离出产物中的NH3,降低生成物浓度,平衡向正反应方向移动,氢气转化率增大,d正确,答案选ad。
(2)①根据方程式可知正方应是体积增大的可逆反应,因此增大压强平衡向逆反应方向移动,甲烷的平衡含量增大。根据图像可知,在温度相同时P2曲线对应的甲烷含量高,所以压强关系是P1<P2。
②根据图像可知,在压强恒定时,随之温度的升高,甲烷的含量降低。这说明升高温度平衡向正反应方向移动,即正方应是吸热反应。
(3)① CO(g) + H2O(g) CO2 (g) + H2(g)
CO2 (g) + H2(g)
起始浓度(mol/L) 0.2 0.2 0 0
转化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.08 0.12 0.12
所以根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该温度下平衡常数K= =
= =
= 。
。
平衡时CO的转化率= ×100%=60%。
×100%=60%。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、该反应是体积不变的可逆反应,因此反应前后压强始终是不变,所以容器内压强不随时间改变不能说明反应达到平衡状态,a不正确;b、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,即密度始终是不变的,所以混合气体的密度不随时间改变不能说明反应达到平衡状态,b不正确;c、单位时间内生成a mol CO2的同时必然同时生成amol氢气,又因为消耗a mol H2,这说明正逆反应速率相等,反应达到平衡状态,c正确;d、混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6,此时Q= =
= =
= ,所以反应达到平衡状态,d正确,答案选cd。
,所以反应达到平衡状态,d正确,答案选cd。
考点:考查外界条件对平衡状态的影响、平衡状态判断、平衡常数以及转化率的有关计算

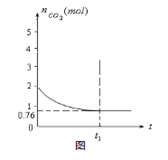
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:
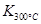 >
>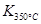 ,则该反应是 热反应。
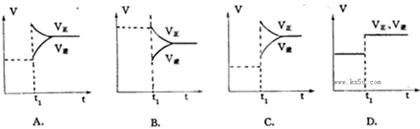
,则该反应是 热反应。(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。
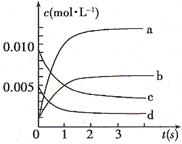
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.NO、O2、NO2的浓度之比为2:1:2
D.容器内密度保持不变
E.容器内气体的颜色不再变化
(4)缩小容器体积使压强增大,平衡向 反应方向移动(填“正”或“逆”),K值 (填“增大”、“减小”或“不变”)
某温度下,将2mol A和2.8 mol B充入体积为2 L的恒容密闭容器中,发生如下反应:
aA(g)+B(g) 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
(1) 5 min内用B表示该反应的化学反应速率为 。
(2)该温度下,此可逆反应的逆反应的平衡常数为 。
(3)a的值为 。
(4)下列说法一定能说明上述反应已达到平衡状态的是 。
①单位时间里每生成1molB的同时消耗了2mol的C ②D的物质的量不再变化
③混合气体的密度不再变化 ④混合气体的平均相对分子质量不再变化
⑤体系的压强不再变化
(5)该温度下,某同学设计了以下实验,请在空格中填入热量(含Q的表达式表示)
| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 | |
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
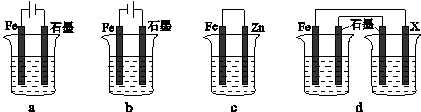
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a-c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
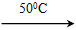 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q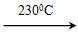 Ni(s)+4CO(g)
Ni(s)+4CO(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白: CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示: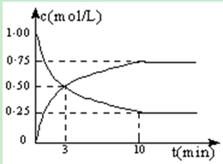

 2CO(g) △H>0
2CO(g) △H>0