题目内容
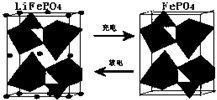
9.LiFePO4电池中某电极的工作原理如图:(1)该电池的电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),该电极反应式为FePO4+e-+Li+=LiFePO4.
(2)用此电池电解含有0.1mol/L CuSO4和0.1mol/L NaCl的混合溶液100mL,假如电路中转移了0.02mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是0.168L;该电解过程中阴极的电极反应式为Cu2++2e-=Cu.
(3)铁做阳极,碳做阴极电解饱和食盐水,写出电极反应式和总电解方程式:
阳极:Fe-2e-=Fe2+ 阴极:2H++2e-=H2↑ 总反应:Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2↓+H2↑.
分析 (1)在原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据得失电子确定正负极,根据反应物、生成物书写电极反应式;
(2)由离子放电顺序可知,电解含有0.01molCuSO4和0.01molNaCl的混合溶液100ml,阳极上氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,阴极上铜离子得电子,以此计算;
(3)铁做阳极,碳做阴极电解饱和食盐水,阳极Fe失电子,阴极氢离子得电子.
解答 解:(1)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4,
故答案为:正;FePO4+e-+Li+=LiFePO4;
(2)电解含有0.01mol CuSO4和0.01molNaCl的混合溶液100mL,电路中转移了0.02mol e-,
阳极:2Cl--2e -=Cl2↑,
0.01mol 0.01mol 0.005mol
4OH--4e-=2H2O+O2↑,
0.01mol 0.01mol 0.0025mol
阴极:Cu2++2e-=Cu
0.01mol 0.02mol
所以阳极上生成的气体在标准状况下的体积=(0.005mol+0.0025mol)×22.4L/mol=0.168L;
故答案为:0.168;Cu2++2e-=Cu;
(3)铁做阳极,碳做阴极电解饱和食盐水,阳极Fe失电子生成亚铁离子,则阳极的电极方程式为Fe-2e-=Fe2+,阴极氢离子得电子生成氢气,则阴极的电极方程式为:2H++2e-=H2↑;溶液中生成Fe2+、H2、和OH-,则电解的总方程式为:Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2↓+H2↑;
故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2↓+H2↑.
点评 本题考查了化学电源新型电池,熟悉元素化合价是解本题关键,根据图片中得失电子判断正负极,再结合图片书写电极反应式,注意根据电子守恒计算,题目难度不大.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 自来水中通入少量Cl2进行消毒杀菌 | |
| B. | 用小苏打(NaHCO3)发酵面团制作馒头 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| D. | 用SO2漂白食品 |
| A. | 适当加热新制的氯水时,溶液的pH逐渐减小 | |
| B. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
| A. | 1molY,1molZ | B. | 2mol X,1molY,1molN2 | ||
| C. | 1molY和3molZ | D. | 2molZ |
 .
.