题目内容
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:
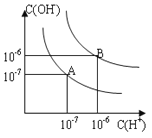
(1)则25℃时水的电离平衡曲线应为______(填“A”或“B”),请说明理由______________。
(2)95℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______。
(3)25℃时,将pH=11的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:________________________。
【答案】A 水的电离是吸热过程,温度低,电离程度小,c(H+)、c(OH-)小 a+b=13或 pH1+pH2=13 2:9 曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA和NaOH中和后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5
【解析】
(1)根据水的电离是吸热过程,升高温度,使水的电离程度增大分析;
(2) 95℃时水的离子积常数Kw=1×10-12,根据两种溶液恰好反应时,n(H+)=n(OH-)计算;
(3) 25℃时水的离子积常数Kw=1×10-14,将pH=11的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=10,溶液显碱性,根据酸、碱反应的物质的量关系,计算出过量的OH-的浓度,利用pH=-lgc(H+)计算NaOH溶液与H2SO4溶液的体积比;
(4)根据曲线B对应温度下水的离子积常数Kw=1×10-12,混合溶液pH=5,说明反应后溶液显示酸性,根据反应后氢离子过量分析。
(1)水是一种极弱的电解质,在溶液中存在电离平衡,电离过程吸收热量,当温度升高时,促进水电离,水的离子积也增大,水中氢离子浓度、氢氧根离子浓度都增大,但由于c(H+)=c(OH-),实验溶液仍然呈中性;因此结合图象中A、B曲线变化情况可知A曲线上c(H+)、c(OH-)较小,水电离程度较弱,因此可以判断25℃时水的电离平衡曲线应为A;
(2)根据图象可知:95℃时,水的离子积常数Kw=1×10-12,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则10×10-a=1×![]() ,10(1-a)=10(b-12),1-a= b-12,所以a+b=13,即混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2=13;
,10(1-a)=10(b-12),1-a= b-12,所以a+b=13,即混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2=13;
(3)25℃时,水的离子积常数Kw=1×10-14,pH=11的NaOH溶液,c(OH-)=10-3mol/L,pH=4的H2SO4溶液c(H+)=10-4mol/L,两种溶液混合,发生反应:H++OH-=H2O,二者反应的物质的量的比是1:1,若所得混合溶液的pH=10,说明碱过量,反应后溶液中c(OH-)=10-4mol/L则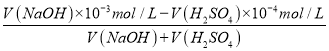 =10-4mol/L,解得V(NaOH):V(H2SO4)=2:9;
=10-4mol/L,解得V(NaOH):V(H2SO4)=2:9;
(4)95℃时,水的离子积为:c(H+)c(OH-)=10-12,在该温度下,pH=2的某HA溶液中c(H+)=10-2mol/L,pH=10的NaOH溶液中c(OH-)=10-2mol/L,两种溶液中c(H+)=c(OH-)=10-2mol/L,当二者等体积混合后,酸电离产生的H+恰好被中和,而混合溶液的pH=5,溶液显酸性,说明反应后酸过量,溶液中存在未电离的电解质分子又发生了电离作用,证明HA为弱酸,电离的HA和NaOH中和后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。


