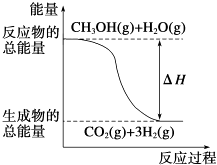
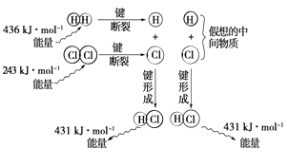
��Ŀ����
����Ŀ��25��ʱ��0.1mol Na2CO3�����������õ�һ�����Ϊ1L����Һ����Һ�в�������pH �Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ���ǣ� �� 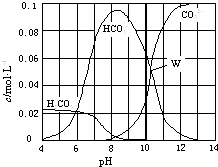
A.W����ʾ����Һ�У�c��CO32����=c��HCO3������c��OH������c��H+��
B.pH=4����Һ�У�c��H2CO3��+c��HCO3����+c��CO32����=0.1molL��1
C.pH=8����Һ�У�c��Na+����c��HCO3������c��H2CO3����c��CO32����
D.pH=11����Һ�У�c��Na+��+c ��H+��=c��OH����+c��Cl����+c��CO32����+c��HCO3����
���𰸡�AC
���������⣺A��W����ʾ����Һ��c��CO32����=c��HCO3��������Һ�Լ��ԣ���c��OH������c��H+����������Һ������Ũ�ȹ�ϵΪ��c��CO32����=c��HCO3������c��OH������c��H+������A��ȷ�� B��pH=4��˵����Ӧ����CO2���ɣ����Ը��������غ��֪c��H2CO3��+c��HCO3����+c��CO32������0.1 molL��1 �� ��B����
C������ͼ���֪pH=8ʱ����Һ��̼�����Ƶ�Ũ��ԶԶ����̼���Ƶ�Ũ�ȣ���˵����Ӧ��ǡ��������̼�����ƣ�HCO3����ˮ��̶ȴ��ڵ���̶ȣ���c��Na+����c��HCO3������c��H2CO3����c��CO32��������C��ȷ��
D������ͼ���֪pH=11ʱ����Һ̼���Ƶ�Ũ��ԶԶ����̼�����Ƶ�Ũ�ȣ���Һ�е���غ�Ϊ��c��Na+��+c ��H+��=c��OH����+c��Cl����+2c��CO32����+c��HCO3��������D����
��ѡAC��

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�