题目内容
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是

 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
C
试题分析:发生AsO43-+2I-+2H+
 AsO33-+I2+H2O,为可逆反应,故调节pH(改变H+浓度)可以改变反应的方向,故A正确;根据图示:当pH=0.68时,电压负为0,故反应处于相对静止状态,即化学平衡状态,故B正确;pH=5时与pH=0.68时相比,H+浓度减小,平衡向逆反应方向移动,即发生AsO33-+I2+2OH-
AsO33-+I2+H2O,为可逆反应,故调节pH(改变H+浓度)可以改变反应的方向,故A正确;根据图示:当pH=0.68时,电压负为0,故反应处于相对静止状态,即化学平衡状态,故B正确;pH=5时与pH=0.68时相比,H+浓度减小,平衡向逆反应方向移动,即发生AsO33-+I2+2OH- AsO43-+2I-+H2O,该反应AsO33-发生氧化反应,为负极,故负极反应式AsO33-+H2O-2e-=AsO43-+2H+,故C错误;pH>0.68时与pH=0.68时相比,H+浓度减小,平衡向逆反应方向移动,即发生AsO33-+I2+2OH-
AsO43-+2I-+H2O,该反应AsO33-发生氧化反应,为负极,故负极反应式AsO33-+H2O-2e-=AsO43-+2H+,故C错误;pH>0.68时与pH=0.68时相比,H+浓度减小,平衡向逆反应方向移动,即发生AsO33-+I2+2OH- AsO43-+2I-+H2O,该反应中I2为氧化剂,AsO43-为氧化产物,所以氧化性I2>AsO43-,故D正确。
AsO43-+2I-+H2O,该反应中I2为氧化剂,AsO43-为氧化产物,所以氧化性I2>AsO43-,故D正确。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是 B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大
B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是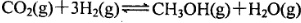 ,5 min后反应达到平衡时c(CH3OH)为0.2 mol
,5 min后反应达到平衡时c(CH3OH)为0.2 mol 。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是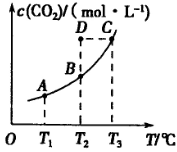
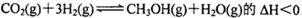
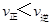
 Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是  pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是