题目内容
【题目】铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验现象有干扰,过多的NO、NO2又会污染环境。改进实验的设计符合绿色化学的思想。某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化。
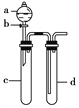
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是____________________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜块,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是___________________________________________。
(3)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是__________,理由是________________________________________________________________________。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该兴趣小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为_______________________,实验现象为________________________________;但此实验的不足之处是___________________________________。
【答案】 检查装置气密性 Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 丙 硝酸耗量少,产物无污染 向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸 c中有黄绿色气体产生,d中溶液变为橙色 没有尾气吸收装置
【解析】(1)连接装置后的第一步是检查装置气密性,观察d中有气泡即可。
(2)c中进行的是单质铜和浓硝酸的反应,所以方程式为Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
(3)甲中反应为:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O;乙中反应为:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O;丙中反应为:2Cu+O2+4HNO3(稀) === 2Cu(NO3)2+2H2O。所以得到相同的硝酸铜,丙方案需要的硝酸最少,且没有污染性的气体产生。
(4)高锰酸钾会氧化浓盐酸生成氯气(黄绿色),氯气通入溴化钾溶液中,将溴离子氧化为溴单质,形成溴水,溶液会由无色变为橙色。本实验的最大问题就是没有氯气的尾气吸收装置。

 名校课堂系列答案
名校课堂系列答案