题目内容
8.利用下列实验装置图可以达到实验目的是( )| A. | 此装置可以实现Cl2的制取、收集、尾气吸收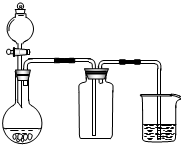 | |
| B. | 此装置可以实现乙酸乙酯的制取和收集 | |
| C. | 此装置可以形成Cu-Zn原电池 | |
| D. | 此装置可证明H2CO3酸性大于H2SiO3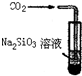 |
分析 A.实验室用二氧化锰和浓盐酸共热制取氯气;
B.乙酸乙酯在碱性条件下可发生水解反应;
C.该装置图中的硫酸铜溶液和硫酸锌溶液应互换,方可构成Cu-Zn原电池;
D.根据“较强酸制较弱酸”分析.
解答 解:A.实验室用二氧化锰和浓盐酸共热制取氯气,该装置缺少加热仪器,故A错误;
B.乙酸乙酯在碱性条件下可发生水解,应把氢氧化钠溶液改为饱和碳酸钠溶液,故B错误;
C.该装置图中的硫酸铜溶液和硫酸锌溶液应互换,方可构成Cu-Zn原电池,故C错误;
D.二氧化碳通入硅酸钠溶液可发生反应Na2SiO3 +CO2+H2O=H2SiO3↓+Na2CO3,说明碳酸的酸性大于硅酸,故D正确;
故选D.
点评 本题考查了气体制备原理和装置、原电池装置、较强酸制较弱酸,综合性较强,难度一般,注意有盐桥的原电池装置中,两种电解质溶液所处的位置.

练习册系列答案
相关题目
11.A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
请回答下列问题:
(1)A的氢化物分子的电子式是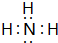 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键
(3)A、D的氢化物相互反应,产生白色固体NH4Cl(填化学式),对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子的电子式是
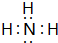 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键
(3)A、D的氢化物相互反应,产生白色固体NH4Cl(填化学式),对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
16.在恒温恒容的密闭容器中发生反应:Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g).下列说法不正确的是( )
| A. | 该反应的平衡常数表达式:K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$ | |
| B. | 若容器内气体的压强保持不变,说明该反应已达到平衡状态 | |
| C. | 若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | |
| D. | 经2min后,H2浓度下降了0.1mol.L-1则反应速度为v(H2O)=0.05mol.L-1.min-1. |
3.100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
(1)在0~40s时段,化学反应速率v(NO2)为0.0025mol•L-1•s-1;
此温度下的化学平衡常数K为0.36.
(2)下列能说明该反应达到平衡状态的是BD
A.2v(N2O4)=v(NO2)
B.体系的颜色不再改变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热反应(填“吸热”或“放热”),判断的理由是降低温度平衡向放热反应方向移动,降低温度c(N2O4)浓度增大,平衡逆向移动.
(4)该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:BC
A.充入一定量的NO2
B.增大容器的容积
C.分离出一定量的NO2
D.充入一定量的N2
(5)100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)<v逆(N2O4).(填“>”、“=”或“<”)
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
此温度下的化学平衡常数K为0.36.
(2)下列能说明该反应达到平衡状态的是BD
A.2v(N2O4)=v(NO2)
B.体系的颜色不再改变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热反应(填“吸热”或“放热”),判断的理由是降低温度平衡向放热反应方向移动,降低温度c(N2O4)浓度增大,平衡逆向移动.
(4)该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:BC
A.充入一定量的NO2
B.增大容器的容积
C.分离出一定量的NO2
D.充入一定量的N2
(5)100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)<v逆(N2O4).(填“>”、“=”或“<”)
20.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A. | CH3CH2CH2CH3 | B. |  | C. | CH3CH2CH3 | D. |  |
18. 将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )
将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )
 将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )
将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )| A. | 固体NaOH | B. | 浓H2SO4 | ||
| C. | Ba(OH)2•8H2O与NH4Cl糊状物 | D. | CaO固体 |
 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: