��Ŀ����
2��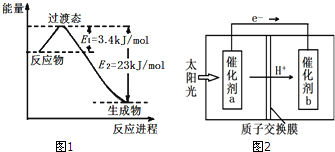 ������CO2����ƫ���������ЧӦ��Ҳ������彡�����Ӱ�죻CO2����;�㷺������ʹ����ɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
������CO2����ƫ���������ЧӦ��Ҳ������彡�����Ӱ�죻CO2����;�㷺������ʹ����ɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ������1��һ��������CO2���Ƶ�Na2CO3��NaHCO3�ȣ�
�ٵ����ʵ���Ũ�ȵ�Na2CO3��NaHCO3��Һ������ǰ�ߣ����ߣ��������������=������
���������������ʵ���Ũ�Ⱦ�Ϊ0.1mol/L�ĵ������Һ������ϡ����ͬ����ʱ��pH�仯������E������ĸ��ţ���
A��Na2CO3B��NaHCO3 C��NaAlO2 D��CH3COONa E��NaOH
��2����֪��ӦFe��s��+CO2��g��?FeO��s��+CO��g����H=a kJ/mol������ڲ�ͬ�¶��£�
�÷�Ӧ��ƽ�ⳣ��K���¶ȵı仯���£�
| �¶ȣ��棩 | 300 | 500 | 700 |
| K | 3.00 | 3.47 | 4.40 |
��3��Ŀǰ��ҵ�Ͽ�����CO2��H2��230�桢���������·�Ӧ���ɼ״�������ˮ������ͼ1Ϊ��ѹ������0.5mol CO2��1.5mol H2��Ӧת���ʴ�80%ʱ�������仯ʾ��ͼ����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��=CH3OH��g��+H2O��g����H=-49 kJ/mol��
��4���˹���������ܹ�����̫���ܣ���CO2��H2O�Ʊ���ѧԭ�ϣ�ͼ2���Ʊ�HCOOH��ʾ��ͼ������Ҫ��ش����⣺
�ٴ���b����ĵ缫��ӦʽΪCO2+2e-+2H+=HCOOH��
�ھ��ⶨ����ÿ����ͨ�����ӽ���Ĥ��H+�����ʵ���Ϊ40mol����ÿСʱ�ɲ���O219.2Kg��
���� ��1����̼�����ˮ��̶ȴ���̼�������ˮ��̶ȣ�
������ˮ��������ʱ����Һϡ��ʱ��ˮ��̶�����ϡ����ͬ������pH�仯��ǿ�ᡢǿ���pH�仯С��
��2���ɱ������ݿ�֪�������¶ȣ�ƽ�ⳣ������˵��ƽ��������Ӧ��Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ���
��ƽ��ʱ�μӷ�Ӧ������̼Ϊnmol��������ʽ��ʾ��ƽ��ʱ������̼��CO�����ʵ��������ڷ�Ӧ��������Ļ�ѧ������ȣ������ʵ�������Ũ�ȴ���ƽ�ⳣ��K=$\frac{c��CO��}{c��C{O}_{2}��}$���㣬�������������̼��ת���ʣ�
��3������ͼ1��֪0.5mol CO2��1.5mol H2ת���ʴ�80%ʱ����23kJ-3.4kJ=19.6KJ��Ȼ�������㣺CO2��g��+3H2��g��?CH3OH��g��+H2O��g���ġ�H��������д�÷�Ӧ���Ȼ�ѧ����ʽ��
��4������ͼ��֪��������a������ͨ����������b����aΪ������bΪ����������������ԭ��Ӧ��������̼��õ��ӣ������Ӳ��뷴Ӧ�õ�HCOOH��
�ڸ�������ˮʧȥ���ӵõ������������ӣ��缫��ӦʽΪ��2H2O+4e-=O2��+4H+��������������ͨ�����ӽ���Ĥ����b�ˣ����ݵ缫��Ӧʽ���������������ʵ������ٸ���m=nM��������������
��� �⣺��1����̼�����ˮ��̶ȴ���̼�������ˮ��̶ȣ��ʵ����ʵ���Ũ�ȵ�Na2CO3��NaHCO3��Һ��Na2CO3��Һ���Խ�ǿ���ʴ�Ϊ������
��NaOHΪǿ���Na2CO3��NaHCO3 ��NaAlO2 ��CH3COONa ��Һ���������ˮ�⣬������Һ�ʼ��ԣ���Һϡ��ʱ��ˮ��̶�����ϡ����ͬ���������ǵ�pH�仯��NaOH��pH�仯С��
��ѡ��E��
��2���ɱ������ݿ�֪�������¶ȣ�ƽ�ⳣ������˵��ƽ��������Ӧ��Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H��0����a��0��
��ƽ��ʱ�μӷ�Ӧ������̼Ϊnmol����
Fe��s��+CO2��g��?FeO��s��+CO��g��
��ʼ��mol����4 0
ת����mol����n n
ƽ�⣨mol����4-n n
���ڷ�Ӧ��������Ļ�ѧ������ȣ������ʵ�������Ũ�ȼ���ƽ�ⳣ������K=$\frac{c��CO��}{c��C{O}_{2}��}$=$\frac{n}{4-n}$=3�����n=3���ʶ�����̼��ת����Ϊ$\frac{3mol}{4mol}$��100%=75%��
�ʴ�Ϊ������75%��
��3������ͼ1��֪0.5mol CO2��1.5mol H2ת���ʴ�80%ʱ����23kJ-3.4kJ=19.6KJ����CO2��g��+3H2��g��?CH3OH��g��+H2O��g���ġ�H=-��19.6kJ��$\frac{1mol}{0.5mol��80%}$��=-49kJ/mol���ʸ÷�Ӧ���Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��=CH3OH��g��+H2O��g����H=-49 kJ/mol��
�ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��g��+H2O��g����H=-49 kJ/mol��
��4������ͼ��֪��������a������ͨ����������b����aΪ������bΪ����������������ԭ��Ӧ��������̼��õ��ӣ������Ӳ��뷴Ӧ�õ�HCOOH���缫��ӦʽΪ��CO2+2e-+2H+=HCOOH��
�ʴ�Ϊ��CO2+2e-+2H+=HCOOH��
�ڸ�������ˮʧȥ���ӵõ������������ӣ��缫��ӦʽΪ��2H2O+4e-=O2��+4H+��ÿ����ͨ�����ӽ���Ĥ��H+�����ʵ���Ϊ40mol����ÿСʱ��������Ϊ40mol��60��$\frac{1}{4}$=600mol������������������Ϊ600mol��32g/mol=19200g=19.2Kg��
�ʴ�Ϊ��19.2��
���� ��Ŀ�ۺ��Խ�ǿ���漰����ˮ�⡢ƽ�ⳣ��Ӱ�����ؼ��йؼ��㡢�Ȼ�ѧ����ʽ��д��ԭ���ԭ��������ȣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ�������������������Ѷ��еȣ�

 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д� BaS��һ�ְ�ɫ���壬����ˮ���������Ʊ����·ۡ�Na2S�ȣ���ҵ�Ͽ���H2���ؾ�ʯ��BaS04���ڸ����·�Ӧ�Ʊ�BaS���Ȼ�ѧ����ʽΪBaS04��s��+4H2��g��?BaS��s��+4H20��g����H=+xkJ•mol-1��x��0�����ش��������⣺
BaS��һ�ְ�ɫ���壬����ˮ���������Ʊ����·ۡ�Na2S�ȣ���ҵ�Ͽ���H2���ؾ�ʯ��BaS04���ڸ����·�Ӧ�Ʊ�BaS���Ȼ�ѧ����ʽΪBaS04��s��+4H2��g��?BaS��s��+4H20��g����H=+xkJ•mol-1��x��0�����ش��������⣺��1�����¶Ⱥ��ݻ�����������£���˵���÷�Ӧ���ﵽƽ��״̬����cd������ĸ��ţ���
a��n��H2��=n��H2O�� ��������
b��������ѹǿ���ֲ���
c��v����H2��=v����H2O����
d��ˮ������Ũ�ȱ��ֲ���
��2��ƽ������д�ʩ�ȿ���߷�Ӧ���ʣ��ֿ����H2��ת���ʵ���b������ĸ��ţ���
a��ʹ�ô���������������
b�����߷�Ӧ��ϵ���¶�
c������Ӧ�����������
d����ʱ�ӷ�Ӧ��ϵ�з����ˮ����
��3�����¶Ⱥ㶨ΪT�棬�����Ϊ2L���ܱ������м���һ�������ؾ�ʯ��H2���ڲ�ͬʱ����H2�����ʵ������±���
| ʱ��/min | 0 | t | 2t | 3t | 4t |
| n��H2��/mol | 2.00 | 1.50 | n | 0.90 | 0.80 |
����������ƽ��ת����Ϊa������¶��·�Ӧ�Ļ�ѧƽ�ⳣ��K=$\frac{{a}^{4}}{��1-a��^{4}}$���ú�a�Ĵ���ʽ��ʾ��������ø÷�Ӧ�ﵽƽ��ʱ����Q kJ����x=$\frac{2Q}{a}$���ú�a��Q�Ĵ���ʽ��ʾ����
��4��Ϊ��̽���¶ȡ����巴Ӧ��ı�����Ի�ѧ��Ӧ���ʵ�Ӱ�죬ijͬѧ��һ�̶��ݻ����ܱ������м���һ�������ؾ�ʯ��H2��������±��е�����ʵ�飺
| ������ | T/�� | c��ʼ��H2��/mol•L-1 | �ؾ�ʯ�ıȱ����/m2•g-1 |
| �� | 850 | c1 | 3.4 |
| �� | T1 | 0.80 | 7.6 |
| �� | 900 | 0.80 | 7.6 |
����ֱ������ϵ�л���������ʵ��������Ũ����ʱ��仯����ͼ������ÿ�������ϱ�����Ӧ��ʵ���ţ�
| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | ||||||
| 3 | �� | �� | �� | �� | �� | �� | ||
| 4 | �� | �� |
��2��Ԫ�آܵ����ӽṹʾ��ͼΪ
 ��Ԫ�آ���̬�⻯�����ʽSiH4��
��Ԫ�آ���̬�⻯�����ʽSiH4����3������10��Ԫ���У�������������Ӧˮ����������ǿ���ǣ�HClO4��
��4����٢�Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊr��F����r��Si����r��Na�����ߢ��Ԫ���γ���̬��������ȶ�����ǿ������˳��ΪHF��HCl��PH3��
��5���ٺ͢���Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽ��Al��OH��3+OH-=AlO2-+2H2O��
| A�� | ��-��-��-��-��-�� | B�� | ��-��-��-��-��-�� | C�� | ��-��-��-��-��-�� | D�� | ��-��-��-��-��-�� |
| A�� | �۵�-218�棬������ˮ | |
| B�� | �۵�3 900�棬Ӳ�Ⱥܴ����� | |
| C�� | ������ˮ������ʱ���磬����ʱ������������ | |
| D�� | ������ˮ���۵�ߣ����岻���磬�ۻ�ʱ���� |
���ڱ�����ֻ������ȡ������
���ڱ����ϵ�һ��ȡ����ֻ�����֣�
��1mol��ͬ���칹��������NaHCO3��Ӧ����2mol CO2��
| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
| A�� | ������Ӿ�����������ṹ������̼���֮��ļн�Ϊ109��28�� | |
| B�� | ���������������ԭ�ӱ���ȡ�����γ����ֲ�ͬ�ṹ�ķ��� | |
| C�� | ��������Ҫ�Ļ���ԭ�ϣ���ֽ��������ںϳɰ�����ҵ | |
| D�� | ���顱���ӵ��еļ��飬�ȿ��������ȼ�ϣ��ֿɷ�ֹ��ը |
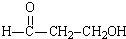 ���뵽����������KMnO4��Һ�У���ַ�Ӧ�����ɱ����ᣬ��Ԫ������������Ϊ+2�ۣ�������KMnO4�����ʵ����ǣ�������
���뵽����������KMnO4��Һ�У���ַ�Ӧ�����ɱ����ᣬ��Ԫ������������Ϊ+2�ۣ�������KMnO4�����ʵ����ǣ�������| A�� | 0.4mol | B�� | 0.6mol | C�� | 0.8mol | D�� | 1.2mol |
| A�� | ��C60����̼ͨԭ�ӵĻ�ѧ���ʲ�ͬ | |
| B�� | ��16O����������ͬ | |
| C�� | ��12C��Ϊͬλ�� | |
| D�� | ������ϩ��ͬ�������� |