��Ŀ����
����Ŀ���Ķ��������в��ϣ�
����1��������Ȼ����ܽ�����¶ȱ仯������ͼ��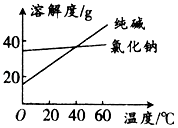
����2�������л�����������ʣ�
���� | �۵�/�� | �е�/�� | �ܶ�/gcm��3 | �ܽ��� |
�Ҷ��� | ��11.5 | 198 | 1.11 | ������ˮ���Ҵ��������л��ܼ� |
������ | 17.9 | 290 | 1.26 | �ܸ�ˮ�;ƾ�������Ȼ��ܣ������������л��ܼ� |
��1����������Ȼ��ƺʹ���Ļ�����з�����������ʵķ�����������ĸ����ͬ�������Ҷ����ͱ��������Һ��������ѷ����ǣ� ��
A����ȡ B������ C���ܽ⡢����Ũ������ȴ�ᾧ������ D����Һ
��2��ij������Ʒ�п��ܺ����Ȼ��ƣ����һ������ʵ�����֤���� �� ��д����Ҫ��������������ͽ��ۣ�
��3��ijͬѧ����������ⶨ������Ʒ�����������Ȼ��ƣ���̼���Ƶ�����������
����1��ȡmg������Ʒ��������������ᣬ��ַ�Ӧ�����������ա����ص�bg���壬�����������Ʒ���ȣ�
����2��ȡmg������Ʒ������ˮ����������Ȼ�����Һ�����ˡ�ϴ�ӡ���ɡ����ص�ag���壬�����������Ʒ���ȣ�
��д������1�漰�ķ�Ӧ�Ļ�ѧ����ʽ����
�����÷���2�е����ݼ���ô���Ĵ��ȣ� ��
���𰸡�
��1��C������
��2��ȡ��Ʒ�������Թ��У���������ˮ�ܽ⣬���������ữ����������Һ�����ְ�ɫ������֤�������Ȼ���
��3��Na2CO3+2HCl=2NaCl+H2O+CO2����![]() ��100%
��100%
���������⣺��1���ܽ�����߱仯��֪̼�����ܽ�����¶��������仯���Ȼ����ܽ�����¶ȱ仯����������Ȼ��ƺʹ���Ļ�����з���������������ܽ�Ȳ��죬��������Ȼ��ƺʹ���Ļ�����з�����������ʵķ����ǣ��ܽ⡢����Ũ������ȴ�ᾧ�����ˣ����Ҷ����ͱ��������Һ����룬����ͼ�������зе㲻ͬ��������������ķ��������¶ȷ������
���Դ��ǣ�C������2��ij������Ʒ�п��ܺ����Ȼ��ƣ����ʵ��֤���IJ�������������ͽ���Ϊ��ȡ��Ʒ�������Թ��У���������ˮ�ܽ⣬���������ữ����������Һ�����ְ�ɫ������֤�������Ȼ��ƣ�
���Դ��ǣ�ȡ��Ʒ�������Թ��У���������ˮ�ܽ⣬���������ữ����������Һ�����ְ�ɫ������֤�������Ȼ��ƣ���3���ٷ���1�漰�ķ�Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+2HCl=2NaCl+H2O+CO2�������Դ��ǣ�Na2CO3+2HCl=2NaCl+H2O+CO2����
��ȡmg������Ʒ������ˮ����������Ȼ�����Һ�����ˡ�ϴ�ӡ���ɡ����ص�ag���壬Ϊ̼��Ƴ��������������̼Ԫ���غ����õ�̼���Ƶ���������= ![]() ��100%=
��100%= ![]() ��100%��
��100%��
���Դ��ǣ� ![]() ��100%��
��100%��

����Ŀ���±�Ϊ�������������е��������ʣ��Լ���ȥ��Щ����Ӧѡ�õ��Լ������������������ȷ���ǣ� ��
ѡ�� | A | B | C | D |
���� | KNO3��Һ | CO2 | ˮ | �Ҵ� |
���� | KOH | H2O��g�� | �� | ˮ |
�����Լ� | FeCl3��Һ | Ũ���� | �ƾ� | ��ʯ�� |
����װ�� |
|
|
|
|
A.A
B.B
C.C
D.D
����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | ̽��Ũ�ȶԻ�ѧƽ���Ӱ�� | ��ʢ��2.5mL 0.005mol/L FeCl3,��Һ���Թ��м���2.5mL 0.015 mol/L KSCN��Һ���ٵμ�4�α���FeCl3��Һ |
B | ��FeCl3��Һ��ȡ��ˮFeCl3 | ��FeCl3��Һ�������� |
C | ֤ �� Ksp(AgCl)>Ksp(AgI) | ��2mL 0.01 mol/LAgNO3��Һ�еμ�1mL0.01 mol/LHCl��Һ���ٵμ�1mL 0.01 mol/LKI ��Һ |
D | ���Ƴ����FeCl3Ũ��Һ | ��FeCl3������������ˮ�н��� |
A. A B. B C. C D. D




