题目内容
阅读下文,对下面加粗部分作出解释.
化学上,将SCN-,OCN-,CN-等离子称为“类卤离子”.现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变为红色.将此溶液分成两份:一份中加入KMnO4溶液,红色褪去;向另一份中通入SO2时,红色也消失,再滴加少量KMnO4溶液,其紫色也褪去.试用离子方程式解释以上三部分颜色变化的原因(方程式可以不配平):________,________,________.
答案:
解析:
提示:
解析:
|
【解答】Fe(SCN)2++ 【巧解导析】此题解答的关键是抓住“类卤离子”的信息.SCN-和Cl-类似,酸性条件下 |
提示:
|
此题的关键是抓住“类卤离子”的性质,再由氧化剂的强弱顺序 |

练习册系列答案
相关题目
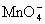 +H+→Fe3++(SCN)2+Mn2++H2O,Fe(SCN)2++SO2+H2O→Fe2++
+H+→Fe3++(SCN)2+Mn2++H2O,Fe(SCN)2++SO2+H2O→Fe2++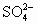 +SCN-+H+,Fe2++
+SCN-+H+,Fe2++