题目内容
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
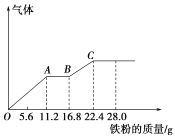
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) ![]() 2NO(g)的△H______0(填“>”或“<”)。
2NO(g)的△H______0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ(N2)=_______________。该温度下,若增大压强此反应的平衡常数将______(填“增大”“减小”“不变”“无法确定”)若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
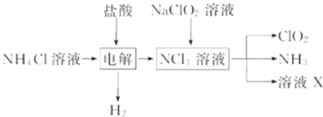
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
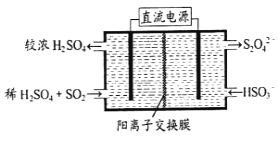
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将含a molCH3COOH的醋酸溶液与含b molBa(OH)2的氢氧化钡溶液混合,充分反应后,溶液呈中性,则醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
【答案】> 0.01mol·L-1·s-1 不变 14.3% SO2+2H2O-2e-=2H++SO42- 1:2 ![]() ×10-7
×10-7
【解析】
(1)①根据“先拐先平速率大”来分析图像而后解题。
②用三段式计算,化学平衡常数只与温度有关。
(2)根据反应类型判断阴、阳极及相应的电极反应。根据得失电子守恒计算。
(3)根据电荷守恒、物料守恒和电离平衡常数的表达式计算。
(1)①由图像可知,T2>T1,由于温度低时氮气的体积分数更大,所以升高温度平衡向正反应方向移动,正反应为吸热反应,即△H>0;
②根据题目信息,可列出三段式:
 ;
;
则υ(N2)=0.5mol/L÷50s=0.01mol·L-1·s-1,
平衡常数只受温度影响,故增大压强,平衡常数不变;
上述反应的平衡常数为![]() ,
,
若开始时向上述容器中充入N2与O2均为1 mol,设N2的转化浓度为xmol/L,则可列出三段式:
 ,
,
![]() ,
,
解得![]() ,
,
则氮气的转化率为 ;
;
(2)①左室通入稀硫酸和二氧化硫,流出浓硫酸,可知二氧化硫发生氧化反应,则阳极的电极反应式为SO2+2H2O-2e-=2H++SO42-;
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成,则反应方程式为![]() ,该反应中氧化剂为二氧化氮,还原剂为S2O42-,氧化剂与还原剂物质的量之比为1:2;
,该反应中氧化剂为二氧化氮,还原剂为S2O42-,氧化剂与还原剂物质的量之比为1:2;
(3)设混合后溶液的体积为VL,溶液中的电荷守恒为![]() ,由于溶液呈中性,则
,由于溶液呈中性,则![]() ,所以2c(Ba2+)=c(CH3COO-)=
,所以2c(Ba2+)=c(CH3COO-)=![]() mol/L,根据物料守恒,c(CH3COOH)=
mol/L,根据物料守恒,c(CH3COOH)=![]() mol/L,Ka=
mol/L,Ka= =
= =
=![]() ×10-7。
×10-7。

【题目】金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀性。如图所示为一种以镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:

已知:室温下难溶物的溶度积数据如下表:
化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-15 | 10-15 | 10-38 |
(1)滤渣1的主要成分为_____________(填化学式)。
(2)用离子方程式解释加入H2O2的作用:_________________。
(3)室温下滴加氨水调节至pH为_________时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________。

(4)电解制备镍的反应原理如上图所示,则A电极的反应式为2H++2e-=H2↑和________________________。
【题目】根据下列实验操作和现象所得的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,分别测量0.1molL-1和0.01molL-1的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液,溶液变成红色 | 原Fe(NO3)2中一定含有Fe3+ |
C | 向AgCl悬浊液中滴入KI溶液,悬浊液变为黄色 | Ksp(AgCl)>Ksp(AgI) |
D | 常温下,分别测量浓度均为0.1molL-1的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
A.AB.BC.CD.D