题目内容
8.分别只用一种试剂除去下列各组中所含的少量杂质(括号内为杂质),在空格中填上需加入的一种试剂:(1)FeCl2溶液(FeCl3)Fe,
(2)FeCl3溶液(FeCl2)Cl2,
(3)Fe 粉末(Al)NaOH溶液.
分析 (1)Fe与氯化铁反应生成氯化亚铁;
(2)氯气与氯化亚铁反应生成氯化铁;
(3)Al与NaOH溶液反应,而Fe不能,以此来解答.
解答 解:(1)Fe与氯化铁反应生成氯化亚铁,则除杂试剂为Fe,故答案为:Fe;
(2)氯气与氯化亚铁反应生成氯化铁,则除杂试剂为Cl2,故答案为:Cl2;
(3)Al与NaOH溶液反应,而Fe不能,则除杂试剂为NaOH溶液,故答案为:NaOH溶液.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应及除杂试剂选择为解答的关键,侧重分析与应用能力的考查,注重元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列关于物质的分类正确的是( )
| A. | 纯碱、烧碱均属于碱 | B. | 氧化钠、过氧化钠属于碱性氧化物 | ||
| C. | 液氨、氨水属于混合物 | D. | 氧化铝属于两性氧化物 |
19.以下现象与电化学腐蚀无关的是( )
| A. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| B. | 生铁比纯铁容易腐蚀 | |
| C. | 铁质器件附有的铜质配件,在接触处容易生铁锈 | |
| D. | 银质物品久置表面变暗 |
3.除去KCl(aq)中混有的少量MgSO4(aq表示溶液),所选用的一种适量的试剂是( )
| A. | KOH(aq) | B. | NaOH(aq) | C. | BaCl2(aq) | D. | Ba(OH)2(aq) |
13.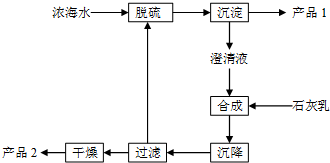 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是 _.
_.
②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl_.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
产品2的化学式为Mg(OH)2;1L浓海水最多可得到产品2的质量为69.6 g.
 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是
 _.
_.②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl_.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
20.下列反应的离子方程式书写正确的是( )
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
 按要求完成下列问题:
按要求完成下列问题:
