题目内容
【题目】NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________ (用离子方程式并结合文字叙述回答)。
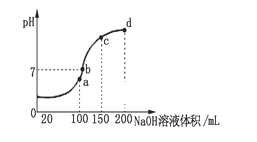
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________________。
(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液与pH=12的氢氧化钠溶液反应后混合液pH=2则二者体积比为_____________
【答案】= l.0×l0-3(或l.0×l0-3-l.0×l0-11) Al3+、NH4+存在水解平衡:Al3++3H2O![]() Al(OH)3+3H+、NH4++H2O
Al(OH)3+3H+、NH4++H2O![]() NH3·H2O+H+,升高温度其水解程度增大,c(H+)增大,pH减小 H++OH-=== H2O 9:2
NH3·H2O+H+,升高温度其水解程度增大,c(H+)增大,pH减小 H++OH-=== H2O 9:2
【解析】
(1)由物料守恒知,NH4Al(SO4)2中NH4+和Al3+物质的量相等,故c(NH4+)+c(NH3H2O)和c(Al3+)+c[Al(OH)3]相等;由电荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),由此分析解答;
(2)温度升高会促进NH4+和Al3+水解,从而导致氢离子浓度变大,pH降低;
(3)向100mL0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液100mL时,仅发生氢离子和氢氧根离子的中和反应;
(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液中c(H+)=0.1mol/L, pH=12的氢氧化钠溶液中c(OH-)=0.01mol/L,反应后混合液pH=2,即c(H+)=0.01mol/L。
(1)由物料守恒知,NH4Al(SO4)2中NH4+和Al3+物质的量相等,故c(NH4+)+c(NH3H2O)和c(Al3+)+c[Al(OH)3]相等;由电荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),所以2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=l.0×l0-3(或l.0×l0-3-l.0×l0-11);
(2)Al3+、NH4+存在水解平衡:Al3++3H2OAl(OH)3+3H+、NH4++H2ONH3H2O+H+,升高温度其水解程度增大,c(H+)增大,pH减小;
(3)向100mL0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液100mL时,仅发生氢离子和氢氧根离子的中和反应,离子方程式为H++OH-=H2O;
(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液中c(H+)=0.1mol/L, pH=12的氢氧化钠溶液中c(OH-)=0.01mol/L,反应后混合液pH=2,即c(H+)=0.01mol/L,设Na HSO4溶液体积为aL,pH=12的氢氧化钠溶液体积为bL,则混合后溶液中c(H+)=![]() =0.01mol/L,解得:a:b=9:2。
=0.01mol/L,解得:a:b=9:2。

【题目】已知298K时下列物质的溶度积
CH3COOAg | AgCl | AgCrO4 | AgS | |
Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积浓度均为0.02molL-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.浓度均为0.01molL-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
【题目】如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
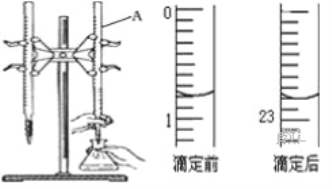
(1)仪器A的名称是__________________;
(2)盐酸滴定管中滴定后读数为_____________mL;
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是________________;(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)_____________;
(5)判断到达滴定终点的实验现象是________________________________;
(6)滴定操作时,如果上述B步骤省略,对测定结果的影响是_____(填“无影响”、“偏高”或“偏低”)。