题目内容
同位素2H、15N、18O、34S等常被用作陆地生态分析研究。下列说法中正确的是( )
| A.16O和18O是同一种核素 |
| B.1H218O的摩尔质量为20 |
| C.34S和15N核内的中子数相差9 |
| D.2H+核外电子数为0 |
D
解析

练习册系列答案
相关题目
下列有关元素的性质及其递变规律正确的是( )
| A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第二周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,水解程度越大 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
依据元素周期表及元素周期律,下列推断正确的是( )
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl、HBr、HI的热稳定性依次增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
| A.所有元素原子的最外层电子数都等于元素的最高化合价 |
| B.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| C.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
下列说法正确的是( )
| A.原子核外电子层数越多,原子半径越大 |
| B.每一主族所含非金属元素的种类可表示为︳族序数-2? |
C.根据泡利原理将氧元素基态原子的电子排布图书写为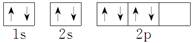 |
| D.C2H2分子中的碳采取sp2杂化 |
短周期元素T、X、Y、Z的原子序数依次增大,T与Z属于同一主族,X、Y、Z最高价氧化物对应的水化物两两之间都能反应,且X、Y、Z原子最外层电子数之和等于X的原子序数。则下列说法正确的是( )。
| A.简单离子半径大小顺序:r(T)>r(X)>r(Y) |
| B.T与Z的最高正化合价相等 |
| C.室温下,单质Y不能与浓硫酸反应 |
| D.用电解法可制得T、X、Y的单质 |
第三周期主族元素R,它的原子最外电子层上达到饱和所需电子数小于次外层和最内层电子数之差,但等于最内层电子数的正整数倍。下列说法正确的是( )
| A.常温下,能稳定存在的R的氧化物都能与烧碱溶液反应 |
| B.在常温下,R的气态氢化物都能在空气中稳定存在 |
| C.在固态时,R的单质都不与NaOH溶液反应 |
| D.R的最高价氧化物对应的水化物都是强酸 |
