题目内容
下列各组离子在指定的环境中一定能大量共存的是( )。
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- |
| B.含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I- |
| C.加入铝粉能产生H2的溶液:NH4+、Fe2+、SO42-、NO3- |
| D.含有大量ClO-的溶液:H+、Mg2+、I-、SO42- |
B
解析

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列离子方程式正确的是( )
| A.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O |
B.磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-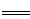 9Fe3++NO↑+14H2O 9Fe3++NO↑+14H2O |
| C.100ml0.1mol/L FeI2溶液与标况下0.224L Cl2: 2Fe2++ Cl2=2Fe3++2Cl- |
| D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -="2" Al(OH)3↓+3BaSO4↓ |
下列解释事实的化学方程式或离子方程式,不正确的是
A.工业上可用电解法制备Mg:MgCl2(熔融) Mg + Cl2↑ Mg + Cl2↑ |
| B.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=2HClO+CaCO3↓ |
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) CaCO3(s) + Na2SO4(aq) CaCO3(s) + Na2SO4(aq) |
| D.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ ="=" 2Cr3+ + Fe3+ + 7H2O |
在加入铝粉能放出H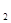 的溶液中,下列各组离子一定不能大量共存的是( )
的溶液中,下列各组离子一定不能大量共存的是( )
A.Na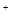 、Fe 、Fe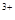 、SO 、SO 、Cl 、Cl |
B.Ba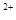 、Mg 、Mg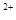 、HCO 、HCO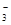 、NO 、NO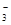 |
C.Na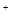 、K 、K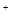 、NO 、NO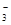 、CO 、CO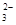 |
D.K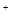 、NO 、NO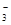 、AlO 、AlO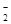 、OH 、OH |
下表中对离子方程式的评价不合理的是
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通入少量的SO2:ClO-+H2O+SO2===Cl-+SO42-+2H+ | 错误,碱性介质中不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O | 正确 |
| C | NH4Al(SO4)2溶液中滴入几滴NaOH溶液:NH4++OH-===NH3·H2O | 错误,OH-首先和Al3+反应生成Al(OH)3沉淀 |
| D | 用惰性电极电解MgCl2溶液:2Mg2++2H2O 2Mg+O2↑+4H+ 2Mg+O2↑+4H+ | 正确 |
下列离子方程式或化学方程式与所述事实相符且正确的是
A. 中投入Na2O2固体: 中投入Na2O2固体: |
| B.向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH- =H2O |
| C.以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O=2Cu+O2↑+4H+ |
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使 完全沉淀:Al3++2 完全沉淀:Al3++2 +2Ba2++4OH-= +2Ba2++4OH-= +2BaSO4↓+2H2O +2BaSO4↓+2H2O |
常温下,下列各组离子一定能大量共存的是( )。
| A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B.在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C.在c(H+)=10-13 mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3- |
| D.在pH=1的溶液中:K+、I-、Cl-、NO3- |
下列图示与对应的叙述相符的是( )
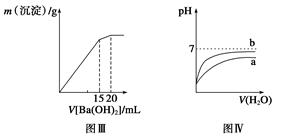
| A.图Ⅰ表示常温下盐酸滴加到0.1 mol·L-1某碱溶液中得到的滴定曲线,由图Ⅰ可知二者恰好中和时,所得溶液的pH>7 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是升高温度 2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是升高温度 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时,沉淀全部是BaSO4 |
| D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
 =CaCO3↓+
=CaCO3↓+ +2H2O
+2H2O