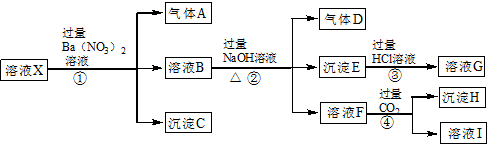
题目内容
 铜锌原电池(如图)工作时,回答下列问题:
铜锌原电池(如图)工作时,回答下列问题:(1)
(2)在外电路中,电子从
(3)正极反应式为
(4)电池反应的离子方程式为
(5)盐桥中的K+移向
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)活泼性强的金属作负极,活泼性弱的作正极;
(2)外电路中电子从负极移向正极;
(3)正极上铜离子得电子;
(4)电池反应为Zn与铜离子的置换反应;
(5)溶液中阳离子向正极移动.
(2)外电路中电子从负极移向正极;
(3)正极上铜离子得电子;
(4)电池反应为Zn与铜离子的置换反应;
(5)溶液中阳离子向正极移动.
解答:
解:(1)活泼性强的金属作负极,活泼性弱的作正极,则Zn为负极;
故答案为:Zn;
(2)外电路中电子从负极移向正极,Zn失电子为负极,Cu为正极,则电子从Zn流向铜;
故答案为:Zn;Cu;
(3)正极上铜离子得电子,正极上的电极反应式为:Cu2++2e-═Cu;
故答案为:Cu2++2e-═Cu;
(4)电池反应为Zn与铜离子的置换反应,则电池反应的离子方程式为Zn+Cu2+═Zn2++Cu;
故答案为:Zn+Cu2+═Zn2++Cu;
(5)溶液中阳离子向正极移动,所以盐桥中的K+移向溶CuSO4液,故答案为:CuSO4.
故答案为:Zn;
(2)外电路中电子从负极移向正极,Zn失电子为负极,Cu为正极,则电子从Zn流向铜;
故答案为:Zn;Cu;
(3)正极上铜离子得电子,正极上的电极反应式为:Cu2++2e-═Cu;
故答案为:Cu2++2e-═Cu;
(4)电池反应为Zn与铜离子的置换反应,则电池反应的离子方程式为Zn+Cu2+═Zn2++Cu;
故答案为:Zn+Cu2+═Zn2++Cu;
(5)溶液中阳离子向正极移动,所以盐桥中的K+移向溶CuSO4液,故答案为:CuSO4.
点评:本题考查原电池的工作原理,侧重于基础知识的考查,题目难度不大,注意两极电极反应式的书写和正负极的判断.

练习册系列答案
相关题目
下列叙述错误的是( )
| A、物质的量是国际单位制中七个基本物理量之一 |
| B、0.016kg16O 含有约6.02×1023个氧原子 |
| C、单位物质的量的任何物质都含有约6.02×1023个原子 |
| D、一定温度、压强下,气体体积由其分子的数目决定 |
下列叙述正确的是( )
| A、能与水反应生成酸的氧化物叫做酸性氧化物 |
| B、碱性氧化物一定是金属氧化物 |
| C、能与活泼金属反应生成氢气的溶液一定是酸 |
| D、既能与酸反应又能与碱反应的化合物一定是两性化合物 |
下列关于电解质的判断中,正确的观点是( )
| A、在熔融状态下能够导电的物质 |
| B、在熔融或溶液中能够导电的物质 |
| C、在熔融或溶液中能够导电的化合物 |
| D、在熔融和溶液中都能导电的化合物 |
下列说法正确的是( )
A、 分子中所有原子共平面 分子中所有原子共平面 |
| B、丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 |
C、化合物  是苯的同系物 是苯的同系物 |
| D、三硝酸甘油酯的分子式为C3H5N3O9 |