题目内容
【题目】下列叙述与图像相对应的是( )。

A. 图A是N2(g)+3H2(g)![]() 2NH3(g)的化学平衡图象,在t0时刻充入一定量的NH3,平衡逆向移动
2NH3(g)的化学平衡图象,在t0时刻充入一定量的NH3,平衡逆向移动
B. 图B中,p2>p1,T1>T2
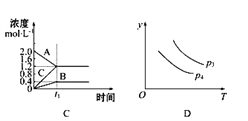
C. 图C表示的化学方程式为2A═B+3C
D. 图D对应反应2X(g)+3Y(g)![]() 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
【答案】B
【解析】A项,在t0时刻充入一定量的NH3,是增大生成物的浓度,则此时是逆反应速率突然增大,正反应速率不变,所以在t0时刻正反应速率应在图像中的原平衡点,故A错误;B项,根据温度越高反应速率越大,反应达到平衡所需的时间就越短和压强越大反应速率越大,反应达到平衡的时间也越短,可以得出“先拐先平数值大”的规律,再根据“控制单一变量法”的规律,在比较温度对反应的影响时应保持压强相等,同理在比较压强对反应的影响时应保持温度相等,所以通过比较a、b两个曲线,可以得出p2>p1,通过比较b、c两个曲线,可以得出T1>T2,故B正确;C项,通过图像判断可知,A的浓度减少,则A为反应物,B、C的浓度增加,则B、C为生成物,A消耗了2.0mol/L-1.2 mol/L=0.8 mol/L,B生成了0.4 mol/L,C生成了1.2 mol/L,根据反应的量之比等于化学计量数之比,可得A、B、C的化学计量数之比等于0.8:0.4:1.2=2:1:3,且到t1时刻,各物质的浓度都不再变化,所以此反应是可逆反应,因此正确的化学方程式是:2A![]() B+3C,所以C错误;D项,因为反应2X(g)+3Y(g)
B+3C,所以C错误;D项,因为反应2X(g)+3Y(g)![]() 2Z(g) ΔH<0,该反应是放热反应,所以升高温度,化学平衡将向逆反应方向移动,造成Y的百分含量增大,所以D错误。故此题答案选B。
2Z(g) ΔH<0,该反应是放热反应,所以升高温度,化学平衡将向逆反应方向移动,造成Y的百分含量增大,所以D错误。故此题答案选B。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:

回答下列问题:
(1)步骤①所得废渣的成分是_____________(写化学式),操作II的名称是________________。
(2)步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4(水层)
2RAn(有机层)+nH2SO4(水层)
③中X试剂为_____________(写化学式)。
(3)按要求完成下列方程式
④的离子方程式为_________________________________________。
加氨水调节pH过程中涉及的离子方程式为: _________________、_______________。
(4)25时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
在实际生产中,⑤中加入氨水,调节溶液的最佳pH为________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_________mol/L(已知:25时,Ksp[Fe(OH)3]=2.610-39)。
(5)该工艺流程中,可以循环利用的物质有___________和_____________。