题目内容
| |||||||||||
解析:
(1) |
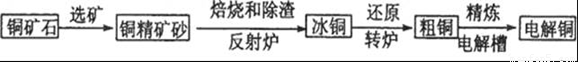
答案:85.8% 精析:n(S)=3.60 g/32 g·mol-1=0.1125 mol m(CuFeS2)=0.1125 mol× 所以矿样中CuFeS2的含量为 |
(2) |
答案:①CuFeS2 ②O2不足量 Cu2S+O2 n(Cu)=〔6-2(15-14.25)〕mol=4.5 mol; ③O2过量 2Cu2S+3O2 n(Cu)=6(1- 精析:①由题目所给3个反应可得如下关系: CuFeS2 ②6 mol CuFeS2和14.25 mol O2反应时,O2不足量,由第一个反应可知,6 mol CuFeS2消耗12 mol O2,剩余的O2发生反应Cu2S+O2 ③6 mol CuFeS2与15.75 mol O2反应时,O2过量,发生第一个反应时消耗12 mol O2,生成3 mol Cu2S,再与过量氧气发生第二个反应,当余下的(15.75~12)mol O2完全反应时,消耗2.5 mol Cu2S,同时生成2.5 mol Cu2O,由第三个反应可知,所得铜的物质的量为n(Cu)=6n(Cu2S) |

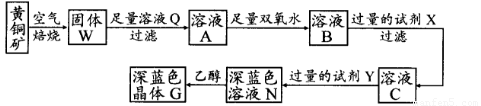
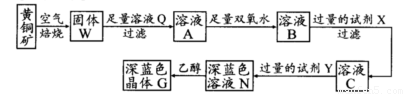
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
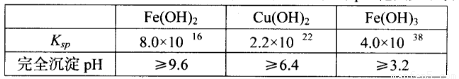
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
|
|
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp |
8.0×10-16 |
2.2×10-22 |
4.0×10-38 |
|
完全沉淀pH |
≥9.6 |
≥6.4 |
≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种):
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ;
用pH试纸测该溶液pH值的方法是
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
(5)在溶液N中加入乙醇的目的是 。