题目内容
(1)写出赤铁矿(Fe2O3)被还原成铁的化学方程式:______.
(2)写出实验室制取氯气反应的离子方程式:______.
解:(1)氧化铁和一氧化碳反应生成铁和二氧化碳,被还原成铁的化学方程式Fe2O3+3CO 2Fe+3CO2;故答案为:Fe2O3+3CO
2Fe+3CO2;故答案为:Fe2O3+3CO 2Fe+3CO2;
2Fe+3CO2;
(2)实验室制取氯气反应的离子方程式为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
分析:(1)氧化铁和一氧化碳反应生成铁和二氧化碳;
(2)实验室制备氯气是利用二氧化锰固体和浓盐酸加热反应生成氯化锰、氯气和水;
点评:掌握反应原理和化学方程式、离子方程式的书写方法,题目较简单.
 2Fe+3CO2;故答案为:Fe2O3+3CO
2Fe+3CO2;故答案为:Fe2O3+3CO 2Fe+3CO2;
2Fe+3CO2;(2)实验室制取氯气反应的离子方程式为:MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;分析:(1)氧化铁和一氧化碳反应生成铁和二氧化碳;
(2)实验室制备氯气是利用二氧化锰固体和浓盐酸加热反应生成氯化锰、氯气和水;
点评:掌握反应原理和化学方程式、离子方程式的书写方法,题目较简单.

练习册系列答案
相关题目
碳单质在工业上有多种用途.
(1)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式是 .
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1= .
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) .
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO的转化率的是 .
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属.若0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,则该反应的化学方程式是 .
(1)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式是 .
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | ||
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1= .
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) .
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO的转化率的是 .
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属.若0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,则该反应的化学方程式是 .
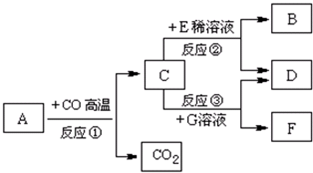 现有A~G七种物质,已知A是赤铁矿的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如右图所示的转化关系:
现有A~G七种物质,已知A是赤铁矿的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如右图所示的转化关系: