题目内容
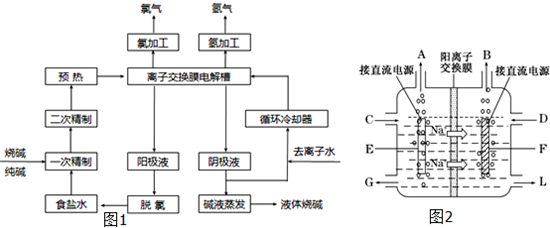
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图所示:

(1)该流程中可以循环的物质是??????????? 。
(2)电解法制碱的主要原料是饱和食盐水,由 于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式???? ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果??? 。
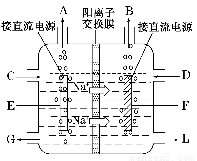
(3)如图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是???? , E电极的名称是???? 。电解总反应的离子方程式为???????? 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为??????????? 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为??????????? 。
(1)氯化钠?? 氢氧化钠???
(2)Ca2++ CO32-= CaCO3↓ ;Mg2+ + 2OH-= Mg(OH)2↓?? 用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。
(3)H2 阳极? 2Cl-+2H2O Cl2↑+H2↑+2OH-(4)Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl
Cl2↑+H2↑+2OH-(4)Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl
(5)ηOH-=(W实 /W理)×100%=(113×32%×1.342×106)/(1.492×1.45×104×300×8)= 48.53/51.92? = 93.46%
【解析】
试题分析:(1)由流程图可以看出:在该流程中可以循环的物质是氯化钠、氢氧化钠。(2)在一次精制中加入Na2CO3溶液发生反应:Ca2++ CO32-= CaCO3↓;加入NaOH发生反应:Mg2+ + 2OH-= Mg(OH)2↓。若食盐水不经过二次精制,用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。(3)根据同种电荷相互排斥,异种电荷相互吸引的原则,Na+不断向F电极区移动,则E电极为阳极,发生的电极反应为:2Cl--2e-=Cl2↑ 。F电极为阴极。在阴极发生的反应为:2H++2e-=H2↑ 。则B处产生的气体是H2. 电解总反应的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH- 。(4)氯气与Na2SO3 发生氧化还原反应的化学方程式为:Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl。(5)m(NaOH实际)= 1.342吨/m3×113m3×32%=48.527t=4.8527×107g, m(NaOH理论)= 1.492×1.45×104×300×8g=5.19216×107g. 该电解槽的电解效率为m(NaOH实际)÷m(NaOH理论) ×100%=4.8527×107g÷5.19216×107g×100%=93.46%.
Cl2↑+H2↑+2OH- 。(4)氯气与Na2SO3 发生氧化还原反应的化学方程式为:Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl。(5)m(NaOH实际)= 1.342吨/m3×113m3×32%=48.527t=4.8527×107g, m(NaOH理论)= 1.492×1.45×104×300×8g=5.19216×107g. 该电解槽的电解效率为m(NaOH实际)÷m(NaOH理论) ×100%=4.8527×107g÷5.19216×107g×100%=93.46%.
考点:考查在氯碱工业生产中的反应原理的化学方程式、离子方程式的书写、操作的原因及电解效率的计算的知识。

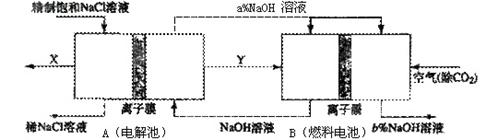 ①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是
①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是

 ①分析比较图中氢氧化鈉质量分数大小:a%
(填“>”、“<”或“=”) b%, 理由是
①分析比较图中氢氧化鈉质量分数大小:a%
(填“>”、“<”或“=”) b%, 理由是