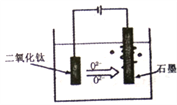
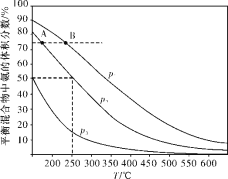
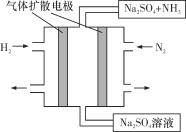
题目内容
【题目】有X、Y、Z三种短周期元素,分别位于不同的周期。已知X和Y原子最外层电子数相同,Z原子次外层只有2个电子,X和Z可以形成离子化合物X2Y,Y和Z可以形成共价化合物Y2Z
(1)写出X、Y、Z三种元素的元素符号:X是____,Y是_____,Z是_____ ;
(2)X2Z的电子式_________, Y2Z的电子式________;
(3)X2Z和 Y2Z反应的化学方程式_________________________。
【答案】Na H O ![]()
![]() Na2O+H2O==2NaOH
Na2O+H2O==2NaOH
【解析】
Z原子次外层只有2个电子,所以Z是第二周期元素,X、Y、Z三种短周期元素,分别位于不同的周期,则X和Y位于第一、第三周期,X和Y原子最外层电子数相同,所以X和Y位于同一主族,X和Z可以形成离子化合物X2Z,Y和Z可以形成共价化合物Y2Z,则Y为氢元素,X为钠元素,Z为氧元素,据此答题。
由分析可知X为Na元素,Y为H元素,Z为O元素。
(1)根据上面的分析可知,X、Y、Z三种元素分别为Na、H、O,故答案为:Na;H;O。
(2)X2Z为氧化钠,它的电子式为![]() ,Y2Z为水,它的电子式为
,Y2Z为水,它的电子式为![]() ,故答案为:
,故答案为:![]() ;
; ![]() 。
。
(3)Na2O和H2O反应的化学方程式为Na2O+H2O=2NaOH,故答案为:Na2O+H2O=2NaOH。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目