题目内容
【题目】下列离子方程式正确的是( )
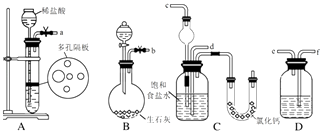
A.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH﹣
B.以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O ![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
C.Ca(ClO)2溶液中通入过量的SO2气体:ClO﹣+SO2+H2O═HClO+HSO3﹣
D.用酸化的高锰酸钾溶液氧化双氧水:2 MnO4﹣+6H++5H2O2═2Mn2++5O2↑+8H2O
【答案】D
【解析】解:A.实验室配制亚铁盐时会加入对应的酸抑制亚铁离子的水解,溶液呈酸性,亚铁离子被氧化成三价铁离子的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,故A错误;B.阳极材料是较活泼的金属,在电流的作用下失电子,则电解时阳极的电极反应:2Ag﹣2e﹣=2Ag+ , 阴极的电极反应:Cu2++2e﹣=Cu,所以总反应:2Ag+Cu2+=2Ag++Cu,故B错误;
C.Ca(ClO)2溶液中通入过量的SO2气体的离子反应为:Ca2++2ClO﹣+2H2O+2SO2=CaSO4↓+4H++2Cl﹣+SO42﹣ , 故C错误;
D.高锰酸根将双氧水氧化成氧气,自身被还原为二价锰离子,反应离子方程式为:2MnO4﹣+6H++5H2O2═2Mn2++5O2↑+8H2O,故D正确;
故选D.

【题目】某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%). 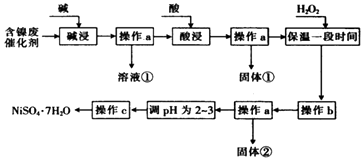
部分阳离子以氢氧化物形式沉淀时的pH如表:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
Al(OH)3 | 3.8 | 5.2 |
Fe(OH)3 | 2.7 | 3.2 |
Fe(OH)2 | 7.6 | 9.7 |
Ai(OH)2 | 7.1 | 9.2 |
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是(填化学式).
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是 .