题目内容
17.X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性强于等电荷数的X阳离子的氧化性;Z的阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小的顺序是( )| A. | ZYXW | B. | WXYZ | C. | XYZW | D. | ZXYW |
分析 X、Y、Z、W四种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,X处于Y的下一周期,且X为金属、Y为非金属;
Z阴离子半径大于等电荷数的Y的阴离子半径,Y与Z处于同一主族,原子序数Z>Y,且Z与X处于同一周期或比X的周期数大;
W的阳离子的氧化性强于等电荷数的X阳离子的氧化性,W与X处于同一主族,金属性W<X,结合“同周期随原子序数增大金属性减弱、非金属性增强,同主族自上而下金属性增强”解答.
解答 解:X、Y、Z、W四种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,X处于Y的下一周期,原子序数X>Y;
Z阴离子半径大于等电荷数的Y的阴离子半径,Y与Z处于同一主族,原子序数Z>Y,Z与X处于同一周期或比X的周期数大,X为金属,Y为非金属,原子序数Z>X;
W的阳离子的氧化性强于等电荷数的X阳离子的氧化性,W与X处于同一主族,金属性W<X,原子序数X>W,W与Y处于同一周期或比Y的周期数小,W为金属,Y为非金属,原子序数Y>W,所以原子序数Z>X>Y>W.
故选D.
点评 本题考查结构与位置关系、元素周期律,侧重对元素周期律的考查,根据电子层排布与离子半径判断元素的相对位置是解题关键,难度中等.

练习册系列答案
相关题目
8.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和水,甲醇和水 |
12.在密闭容器中某气态烃和氧气按一定比例混合,点火爆炸后恢复到原温度(20℃),体积减小至原来的一半,若甲NaOH的溶液则气体全部被吸收,则此烃为( )
| A. | C2H6 | B. | C2H2 | C. | C2H4 | D. | C2H3 |
2.下列离子方程式书写不正确的是( )
| A. | 少量铁粉加入稀盐酸中:Fe+2H+=Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| D. | Na2S溶液中通入足量H2S:S2-+H2S=2HS- |
9.一定温度时,测得反应X(g)+Y(g)═P(g)+Q(g)的平衡常数K=1.0.该温度下向甲、乙、丙三个恒容密闭容器中分别通入气体X和气体Y,其起始浓度如下表所示:
下列说法不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(X)/(mol/L) | 0.10 | 0.10 | 0.20 |
| c(Y)/(mol/L) | 0.15 | 0.18 | 0.30 |
| A. | 反应开始时,甲中反应速率最慢,丙中反应速率最快 | |
| B. | 反应达到平衡时,甲、丙中Q的体积分数相等 | |
| C. | 乙中反应达到平衡时,X的转化率大于60% | |
| D. | 甲中反应达到平衡时,c(Y)=0.10mol/L |
6.以NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在标准状况下,11.2 L己烷含有分子数为0.5NA | |
| B. | 4.2 g乙烯和环丙烷的混合气体含有H原子数为0.6NA | |
| C. | 甲基(-CH3)的电子总数为10NA | |
| D. | 在常温常压下,2.24 L丁烷和2-甲基丙烷的混合气体所含分子数为0.1NA |
4.下列几种方法中,哪种方法最适合用于测定有机化合物中的卤素( )
| A. | 钠融法 | B. | 铜丝燃烧法 | C. | 核磁共振法 | D. | 红外光谱法 |
 ;取代反应
;取代反应 ,加聚反应
,加聚反应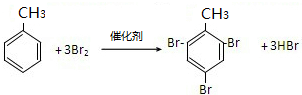 ;取代反应.
;取代反应.