题目内容
将22.4g铜和氧化铁的混合物粉末加入到浓度为1 mol•L-1的硫酸中,使之发生反应。⑴若固体恰好全部溶解,消耗硫酸的体积为V L ,求V的取值范围。
⑵若硫酸溶液过量,反应后溶液的体积为1 L,测得此溶液中Fe2+浓度为0.1 mol•L-1,求原混合物含铜多少克。
答案:
解析:
提示:
解析:
| ⑴0.30≤V<0.42; ⑵3.2g或14.4g
|
提示:
| ⑴有关化学反应为:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe2(SO4)3+Cu=CuSO4+2FeSO4 因此,Fe2O3越多,消耗H2SO4越多,此时,可求得V=0.42L;Fe2(SO4)3与Cu正好完全反应时,消耗H2SO4最少,此时,求得V=0.30 L。 ⑵由Fe2(SO4)3+Cu=CuSO4+2FeSO4, 若Cu完全反应,n(Cu)= 若
|

练习册系列答案
相关题目

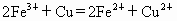 在水溶液中能发生,将22.4g铜和三氧化二铁的混合粉末加入到浓度为1mol/L的硫酸中,使之发生反应.
在水溶液中能发生,将22.4g铜和三氧化二铁的混合粉末加入到浓度为1mol/L的硫酸中,使之发生反应.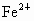 的浓度为0.1mol/L,求原混合物中含铜多少克?
的浓度为0.1mol/L,求原混合物中含铜多少克?
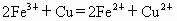 在水溶液中能发生,将22.4g铜和三氧化二铁的混合粉末加入到浓度为1mol/L的硫酸中,使之发生反应.
在水溶液中能发生,将22.4g铜和三氧化二铁的混合粉末加入到浓度为1mol/L的硫酸中,使之发生反应.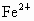 的浓度为0.1mol/L,求原混合物中含铜多少克?
的浓度为0.1mol/L,求原混合物中含铜多少克?