题目内容
(8分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法
该法的工艺流程为
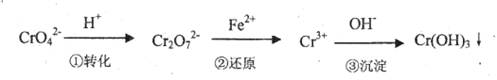
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
方法l:还原沉淀法
该法的工艺流程为

其中第①步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。

(1)平衡体系的pH=2,即溶液为酸性溶液,则溶液显橙色;
(2)能说明第①步反应达平衡状态的是:溶液的颜色不变即各组分的浓度保持不变的状态;
(3)由Ksp=c(Cr3+)?c3(OH-)=10-32,可得,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
(4)用Fe做电极的原因为:Fe为阳极,发生氧化反应,生成 ,提供还原剂
,提供还原剂 ,其电极反应式为:
,其电极反应式为: ;
;
(5)在阴极附近溶液pH升高的原因是: 。溶液中同时生成的沉淀还有氢氧化铁沉淀生成;
。溶液中同时生成的沉淀还有氢氧化铁沉淀生成;
(2)能说明第①步反应达平衡状态的是:溶液的颜色不变即各组分的浓度保持不变的状态;
(3)由Ksp=c(Cr3+)?c3(OH-)=10-32,可得,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
(4)用Fe做电极的原因为:Fe为阳极,发生氧化反应,生成
 ,提供还原剂
,提供还原剂 ,其电极反应式为:
,其电极反应式为: ;
;(5)在阴极附近溶液pH升高的原因是:
 。溶液中同时生成的沉淀还有氢氧化铁沉淀生成;
。溶液中同时生成的沉淀还有氢氧化铁沉淀生成;
练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
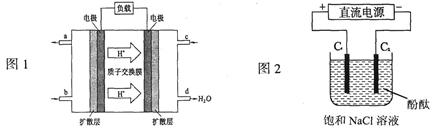
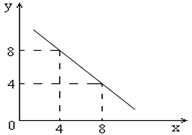
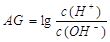 。则该温度下,0.01mol/L盐酸的酸度AG= 。
。则该温度下,0.01mol/L盐酸的酸度AG= 。