题目内容
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)? 2NH3(g) △H=-92.6 kJ/moL。实验测得起始、平衡时有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
- A.容器①、②中反应达平衡时,状态完全相同
- B.①平衡时,N2的转化率为25%
- C.容器②中达平衡时放出的热量Q<23.15 kJ
- D.若向容器①加入2molN2、6molH2,则平衡时放出的热量23.15kJ <Q1<46.3 kJ
D
恒温、恒容非等体积反应,投料转换成相同物质时量相同,则属于等效平衡,平衡后各组分的百分含量相同,A正确;
N2(g)+3H2(g)? 2NH3(g) △H=-92.6 kJ/moL
起始量(moL)1 3 0
变化量 x 3x 2x
平衡量 1-x 3-3x 2x
则; 解得x="0.25" , 转化率=
解得x="0.25" , 转化率= ,B正确;由于②氮气、氢气的投量减少,达平衡时热量Q<23.15 kJ,C正确;若向容器①加入2molN2、6molH2,则平衡时放出的热量Q1>46.3 kJ,D错;
,B正确;由于②氮气、氢气的投量减少,达平衡时热量Q<23.15 kJ,C正确;若向容器①加入2molN2、6molH2,则平衡时放出的热量Q1>46.3 kJ,D错;
恒温、恒容非等体积反应,投料转换成相同物质时量相同,则属于等效平衡,平衡后各组分的百分含量相同,A正确;
N2(g)+3H2(g)? 2NH3(g) △H=-92.6 kJ/moL
起始量(moL)1 3 0
变化量 x 3x 2x
平衡量 1-x 3-3x 2x
则;
 解得x="0.25" , 转化率=
解得x="0.25" , 转化率= ,B正确;由于②氮气、氢气的投量减少,达平衡时热量Q<23.15 kJ,C正确;若向容器①加入2molN2、6molH2,则平衡时放出的热量Q1>46.3 kJ,D错;
,B正确;由于②氮气、氢气的投量减少,达平衡时热量Q<23.15 kJ,C正确;若向容器①加入2molN2、6molH2,则平衡时放出的热量Q1>46.3 kJ,D错; 
练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
| (2009?南通二模)相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应: N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
| ||||||||||||||||||
在相同温度下,体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应.平衡时有关数据如下(已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1).
|
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g);△H=-92.6kJ?mol-1,实验测得反应起始时、达到平衡状态时的有关数据如下表所示,不正确的是( )
| ||||||||||||||||||
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ?mol-1起始时各物质物质的量如下表所示:
达到平衡后,①容器中XY3的物质的量为0.5mol.下列叙述正确的是( )
| 容器 编号 |
起始时各物质物质的量/mol | ||
| X2 | Y2 | XY3 | |
| ① | 1 | 3 | 0 |
| ② | 0.6 | 1.8 | 0.8 |
| A、容器①、②中反应的平衡常数不相等 |
| B、达平衡时,容器②中 XY3的物质的量浓度为2mol?L-1 |
| C、容器①中反应达到平衡时放出的热量为23.15kJ |
| D、容器②中反应达到平衡时放出热量 |
相同温度下,体积均为0.5L的两个恒容密闭容器中发生可逆反应:A(g)+2B(g)?xC(g)△H=-64kJ?mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示.下列叙述错误的是( )
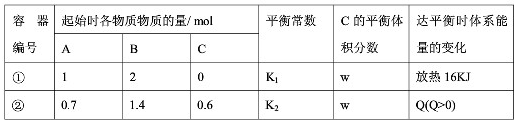

| A、x=2 | B、容器①、②中反应的平衡常数K1=K2 | C、若容器①体积为0.4L,则达平衡时放出的热量可能仍为16kJ | D、达平衡时,两个容器中C的物质的量浓度均为1mol.L-1 |